高纯度镍是许多有机反应的催化剂。某化学课题组拟以电镀废液(含有NiSO4、CuSO4和FeSO4)为原料,设计提取高纯镍的简单工艺如下(阴离子省略):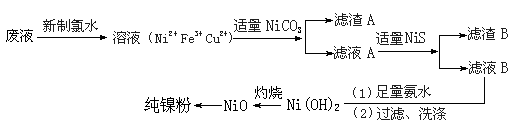
| 难溶电解质 |
NiS |
CuS |
Cu(OH)2 |
Ni(OH)2 |
Fe(OH)3 |
| Ksp或沉淀完全的pH |
1.1×10-21 |
1.3×10-36 |
pH=9 |
pH=9.5 |
pH=3.7 |
注:Ni(OH)2开始沉淀时的pH=7。
(1)加入新制氯水所发生反应的离子方程式为 。
(2)加入NiCO3的目的是 。
(3)在实验室中灼烧所使用的仪器有 。
(4)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥。
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍。
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全等角度评价两种方案的优点。
方案1: 。
方案2: 。
(5)方案2所用的氢气可以选用下列装置中的 来制取(填写字母,下同),收集氢气可选用装置 。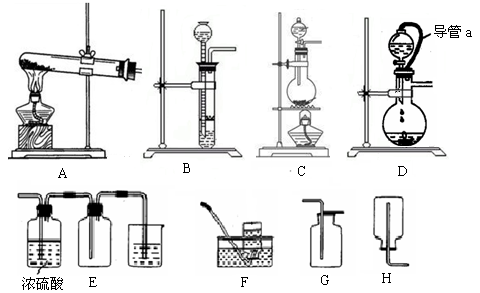
(6)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的 。装置D中导管a的作用是 。
a.CO2 b.Cl2 c.NO d.SO2
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示。中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过。
该电池的总反应式为:Li1-xFePO4+ LixC6="=" C6 + LiFePO4
(1)磷酸铁锂电池放电时,正极反应式为 。
(2)若用该电池电解精炼铜,阴极质量增重19.2g时,则电池中通过聚合物隔膜的Li +数目为 。
(3)以该电池为电源,用Fe2O3为阳极,石墨为阴极,NaOH溶液为电解质溶液制备高铁酸钠(Na2FeO4),写出阳极的电极反应式 。
(4)学生在实验时若被白磷(以P表示)灼伤,可用硫酸铜溶液涂抹伤处,有铜和H3PO4生成,写出此反应的化学方程式 。
(5)一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=8.4×10-36mol2·L-2;H2S:Ka1=1.2×10-7mol·L-1,Ka2=7×10-15mol·L-1
①通过计算说明反应CuS(s)+2H+ Cu2++H2S进行的程度 。
Cu2++H2S进行的程度 。
②常温下,NaHS溶液呈碱性,此溶液中离子浓度由小到大的顺序是 。若向此溶液中加入硫酸铜溶液,恰好完全反应,所得溶液pH 7(填“>”“<”或“﹦”),其原因是 (用离子方程式表示)。
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加
和
,即可得到
,该反应的还原产物为。
(2)上述浓缩液中含有
、
等离子,取一定量的浓缩液,向其中滴加
溶液,当
开始沉淀时,溶液中
为:,已知
=1.8×10-10,
=8.5×10-17。
(3)已知反应
的
,1
、1
分子中化学键断裂时分别需要吸收436
、151
的能量,则1
分子中化学键断裂时需吸收的能量为
。
(4)
研究了下列反应:

在716
时,气体混合物中碘化氢的物质的量分数
与反应时间
的关系如下表:
| 0 |
20 |
40 |
60 |
80 |
120 |
|
| 1 |
0.91 |
0.85 |
0.815 |
0.795 |
0.784 |
|
| 0 |
0.60 |
0.73 |
0.773 |
0.780 |
0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:。
②上述反应中,正反应速率为
正=
正·
,逆反应速率为
逆=
逆·
,其中
正、
逆为速率常数,则
逆为(以
和
正表示)。若
正 = 0.0027
,在
=40
时,
正=
③由上述实验数据计算得到
正~
和
逆~
的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为(填字母)

硫酰氯(SO2Cl2)是重要的化学试剂,可由如下反应制取:SO2(g)+Cl2(g)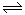 SO2Cl2(g)△H
SO2Cl2(g)△H
针对该反应回答下列问题:
(1)已知:①SO2(g)+Cl2(g)+SCl2(g)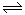 2SOCl2(g)△H1=-akJ/mol
2SOCl2(g)△H1=-akJ/mol
②SO2Cl2(g)+SCl2(g) 2SOCl2(g)△H2=-bkJ/mol(a>b>0)
2SOCl2(g)△H2=-bkJ/mol(a>b>0)
则△H=________kJ/mol(用a、b的代数式表示)
(2)为了提高该反应中Cl2的平衡转化率,下列措施合理的是________(填字母序号)。
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
(3)若在绝热、恒容的密闭体系中,投入一定量SO2和Cl2,发生该反应,下列示意图能说明t1 时刻反应达到平衡状态的是(填字母序号)。(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(4)若在催化剂作用下,将n molSO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P。起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则υ(SO2)= _________。
②此温度下,该反应的K=_________。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是_________。
(5)该反应的产物SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式_______________;已知 于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______。
于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______。
铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集了的气体体积均小于2.24 L(标准状况),最主要的原因是__________________________,所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因______________________________________。
(2)硫化亚铁常用于工业废水的处理。已知:25℃时,溶度积常数Ksp(FeS)=6.3×10-18、Ksp(CdS)= 3.6×10-29。请写出用硫化亚铁处理含Cd2+的工业废水的离子方程式__________________________。
(3)ZnFe2O3.5是一种新型纳米材料,可将工业废气中的某些元素转化为游离态,制取纳米ZnFe2O3.5和用于除去废气的转化关系为:ZnFe2O4 ZnFe2O3.5
ZnFe2O3.5
上述转化反应中消耗的n(ZnFe2O4)︰n(H2)=_______。请写出 ZnFe2O3.5与NO2反应的化学方程式_______________________________。
(4)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
①以FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,该反应的化学方程式为2FePO4+Li2CO3+2C=2LiFePO4+3CO↑。则1molC参与反应时转移的电子数为_______________。
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开)工作原理为FePO4+Li LiFePO4。则充电时阳极上的电极反应式为______________________________。
LiFePO4。则充电时阳极上的电极反应式为______________________________。
(5)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 mol/L 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入_______ml、2 mol/L的盐酸(忽略加入盐酸体积)。
在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
(1)向体积均为20.00 mL、浓度均为0.1 mol·L-1盐酸和醋酸溶液中分别滴加0.1 mol·L-1 NaOH溶液。随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:
①用NaOH溶液滴定醋酸溶液的曲线是__________________(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是______________溶液(填化学式);
③图中V1和V2大小的比较:V1_____V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:
______>______>______>________(用离子的物质的量浓度符号填空)。
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:_____________(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为________(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=______________。
Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]。下列说法不正确的是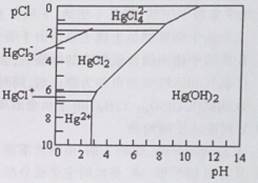
| A.可用如下方法除去污水中的Hg2+: FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq) |
| B.当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在 |
| C.HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCI++Cl- |
| D.当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2 |
(1) 氨催化氧化法是工业制硝酸的主要方法,可进行连续生产。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式_____________________________。
(2) 恒容密闭容器中进行的合成氨反应,其化学平衡常数K与温度t的关系如下表:
| t/K |
298 |
398 |
498 |
… |
| K |
4.1×106 |
K1 |
K2 |
… |
①写出合成氨反应N2(g)+3H2(g) 2NH3(g)的平衡常数表达式:__________________________
2NH3(g)的平衡常数表达式:__________________________
②上表中K1_______K2(填“>”、“=”或“<”)。
(3) 如果向氨合成塔中充入10molN2和40molH2进行氨的合成,图A和图B为一定温度下平衡混合物中氨气的体积分数与压强(p)的关系图。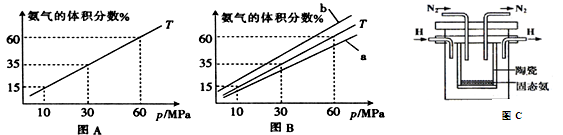
①下列说法正确的是__________(填序号)。
A.图中曲线表明增大体系压强(p),有利于提高氨气在混合气体中体积分数
B.如果图B中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高反应速率和氮气的转化率
D.当 2v正(H2) =3v逆(NH3)时,反应达到平衡状态
E.容器内混合气体密度保持不变时,反应达到平衡状态
②图A中氨气的体积分数为15%时,N2的转化率为 。
(4)在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如图C,则正极的电极反应式 。
(5)25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是( )。
A.25 ℃时,饱和Mg(OH)2溶液中c(OH—)大于饱和MgF2溶液中c(F—)
B.25 ℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.056 1 mol·L-1,则溶液的pH=9
C.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,溶液变澄清,Ksp[Mg(OH)2]增大
D.25 ℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
水是重要的自然资源,与人类的发展密切相关。
(1)25℃时,水能按下列方式电离:
H2O+H2O H3O++OH- K1=1.0×10-14
H3O++OH- K1=1.0×10-14
OH-+H2O H3O++O2- K2=1.0×10-36
H3O++O2- K2=1.0×10-36
水中c(O2-) = mol·L-1(填数值)。
(2)水广泛应用于化学反应。将干燥的碘粉与铝粉混合未见反应,滴加一滴水后升起紫色的碘蒸气,最后得到白色固体。有关该实验的解释合理的是 。
| A.加水使碘和铝粉形成溶液 | B.水作氧化剂 |
| C.碘粉与铝粉反应是放热反应 | D.水作催化剂 |
(3)铁酸铜(CuFe2O4)是很有前景的热化学循环分解水制氢的材料。
ⅰ.某课外小组制备铁酸铜(CuFe2O4)的流程如下: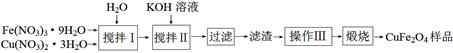
搅拌Ⅰ所得溶液中Fe(NO3)3、Cu(NO3)2的物质的量浓度分别为2.6 mol·L-1、 1.3 mol·L-1。
①搅拌Ⅰ所得溶液中Fe元素的存在形式有Fe3+和 (填化学式)。
②搅拌Ⅱ要跟踪操作过程的pH变化。在滴加KOH溶液至pH=4的过程中(假设溶液体积不变),小组同学绘制溶液中c(Fe3+)、c(Cu2+)随pH变化的曲线如下图,其中正确的是 (用“A”、“B”填空)。
(已知:Ksp[Fe(OH)3]=2.6×10-39、Ksp[Cu(OH)2]=2.2×10-20)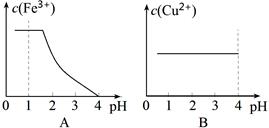
③操作Ⅲ为 、 。
ⅱ.在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
④氧缺位体与水反应制氢的化学方程式为 。
⑤课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)= 。
催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)接触法制硫酸中采用V2O5作催化剂:
4FeS2(s)+11O2(g)=2Fe2O3(s) +8SO2(g) △H=―3412 kJ·mol-1
2SO2(g)+O2(g) 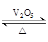 2SO3(g) △H=―196.6 kJ·mol-1
2SO3(g) △H=―196.6 kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H=―130.3 kJ·mol-1
以FeS2为原料,理论上生产2mol H2SO4(l)所释放出的热量为 kJ。
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
①第一步反应的机理可以用图1所示。图中中间产物X的结构简式为 。
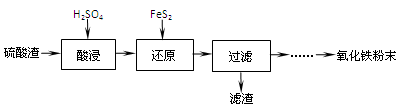
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
8.3 |
| 完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.分离,洗涤;
d.烘干,研磨。
(13分)某条件下,在2 L密闭容器中发生如下反应:2NO2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)
在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800 ℃,实验Ⅲ在850 ℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题: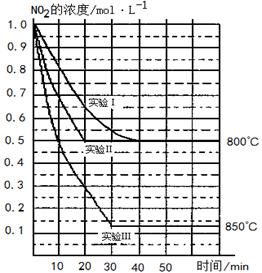
(1)实验Ⅱ隐含的反应条件是 。
(2)实验II中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为 。
(3)800 ℃时,该反应的平衡常数K= ,该反应是 (填“吸” 或“ 放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与O2混合气体(保持温度不变),此时反应将向 进行(填“正反应方向”或“逆反应方向”)。
(5)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,
如:8NH3+6NO2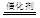 7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
(6)向AlCl3溶液中逐滴加入氨水,发生如下反应Al3++3NH3·H2O Al(OH)3↓+3NH4+ ,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH="4.7" ,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。
Al(OH)3↓+3NH4+ ,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH="4.7" ,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。














工业制硝酸经以下一系列反应: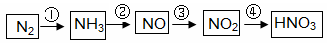
请回答:
(1)写出反应④的化学方程式 ,实验室收集NO的方法是 。
(2)对于氮的化合物,下列说法不正确的是(选填序号字母) 。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(3)已知:H2(g)+1/2 O2(g)=H2O(g) △H1=-241.8kJ/mol
N2(g)+ 3H2(g)=2NH3(g) △H2=-92.0kJ/mol
则34g氨气与氧气反应生成N2(g)与H2O(g)时,△H= kJ/mol。
(4)氨气在微生物的作用下与氧气反应生成HNO2,写出该反应的化学方程式 。
(5)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4)2SO4的部分工艺流程如下: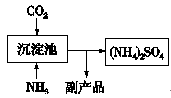
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因(请从溶解度和溶解平衡角度分析) 。
CoCl2•6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,还原性Fe2+>Cl->Co2+;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 、 。
(4)“操作1”中包含的基本实验操作,它们依次是 和过滤、减压烘干。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 ;其使用的最佳pH范围是 。.
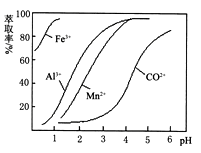
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
锰的化合物是优良的催化剂,可用于干电池原料生产等。
(1)锌锰干电池的反应为2MnO2 +Zn+2NH4Cl ="2" MnO(OH) +Zn(NH3)2Cl2,MnO(OH)中锰元素的化合价为____。
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为 (填化学式)。[已知Ksp(MnS)=1.4×10-1 5,Ksp(ZnS)=2.9×10 -25,Ksp(FeS)=6.0×10-18]
(3) Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g) △H1,其反应机理如下:
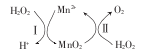
①已知反应Ⅱ为MnO2(s)+H2O2(1) +2H+( aq)=Mn2+(aq) +O2(g)+2H2O(1) △H2。写出反应I的热化学方程式(焓变用△H1和△H2表示): 。
②某温度时,向10 mL0.4 mol.L-1 H2O2液中滴入1滴MnSO4发生分解:2H2O2 =2H2O+O2,测得不同时刻生成O2的体积(已折算为标准状况下的体积)如下表:

0~2 min时反应速率比2~4 min时的快,其原因是_________;
0~6 min的平均反应速率v(H2O2)= (忽略溶液体积的变化)。
(4)锰基催化剂是合成甲醇、二甲醚的催化剂。已知:

①反应I的正反应是 (填“放热”或“吸热”)反应。
②反应Ⅱ的平衡常数表达式为 。