某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是( )
①有晶体析出 ②c(Ca(OH)2)增大 ③pH不变
④c(H+)·c(OH-)的乘积不变 ⑤c(H+)一定增大
| A.① | B.①③ | C.①②④ | D.①⑤ |
(4分)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向
AgCI和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式: ▲ 。
(2)白色固体转化成黑色固体的原因是: ▲ 。
根据以下信息回答下列问题。
Ⅰ .盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。
.盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。
Ⅱ.长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用盐酸除去。
①请用离子方程式表示盐碱地产生碱性的原因: ;
②请用化学方程式表示 加入石膏降低土壤碱性的反应原理 ;
加入石膏降低土壤碱性的反应原理 ;
③请写出水垢悬浊液中CaSO4溶解平衡的离子方程式 ;
④ 请分析水垢中的CaSO4转化为CaCO3的原理 ;
请分析水垢中的CaSO4转化为CaCO3的原理 ;
⑤请写出CaCO3溶于过量盐酸的离子方程式 。
(12分)
Ⅰ.已知常温下,AgCl的Ksp=1.8×10-10,AgBr的Ksp=4.9×10-13。
(1)现向AgCl的悬浊液中:
①加入AgNO3固体,则c(Cl-) (填“变大”、“变小”或“不变”,下同);
②若改加更多的AgCl固体,则c(Ag+) ;
③若改加更多的KBr固体,则c(Ag+) ,c(Cl-) ;
(2)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是 ;
| A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度, Ksp 一定增大 |
| B.两种难溶盐电解质,其中Ksp小的溶解度也一定小 |
| C.难溶盐电解质的Ksp与温度有关 |
| D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变 |
Ⅱ.最近有人制造了一种燃料电池使汽油氧化直接产生电流,其中一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:
(1)以辛烷为汽油的代表物,则这个电池放电时必发生反应的化学方程式是 。
(2)这个电池负极的电极反应式为C8H18 + 25O2- -50e-==8CO2 + 9H2O,,正极的电极反应式为 。固体电解质里O2-的移动方向是 ,向外电路释放电子的电极是 。
室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的溶度积(室温)为2.8×10-9,下列说法 中不正确的是( )
| A.x的数值为2×10-5 |
B.c点时有CaCO3生成 |
| C.加入蒸馏水可使溶液由d点变成a点 | |
| D.b点与d点对应的溶度积相等 |
在溶液中有浓度均为0.0lmol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知: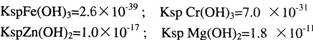
当氢氧化物开始沉淀时,下列哪一种离子所需的pH最小( )
| A.Fe3+ | B.Cr3+ | C.Zn2+ | D.Mg2+ |
常温时,将足量的AgCl固体分别加入同体积的下列各溶液中,溶解的AgCl最少的是( )。
| A.1 mol·L-1的MgCl2溶液 | B.2 mol·L-1的NaCl溶液 |
| C.1.4 mol·L-1的BaCl2溶液 | D.1 mol·L-1的AlCl3溶液 |
将足量BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为:
| A.40mL 水 | B.10mL 0.2mol/LNa2CO3溶液 |
| C.50mL 0.01mol/L 氯化钡溶液 | D.100mL 0.01mol/L盐酸 |
在盛有饱和Ca(OH)2溶液的烧怀中,加入少量CaO粉末,充分作用后,恢复到原温度,下列说法正确的是( )
①有晶体析出 ②Ca(OH)2浓度增大 ③pH不变 ④c(H+)c(OH-)的积不变 ⑤c(OH-)一定增大
| A.① | B.①②③ | C.①⑤ | D.①③④ |
已知部分化合物的溶度积常数见下表:
| 化学式 |
Ksp |
化学式 |
Ksp |
| AgBr |
5.0×10-13 |
Ag2CO3 |
8.1×10-12 |
| Ag3PO4 |
1.4×10-16 |
CaCO3 |
2.8×10-9 |
| AgOH |
2.0×10-8 |
Ca3(PO4)2 |
2.0×10-29 |
现有某种KNO3溶液,其中混有少量KBr和Ca(H2PO4)2杂质,可供选择的试剂有:①AgNO3,②K2CO3,③KOH,④HNO3。若规定不得重复使用试剂,且最后溶液中只允许含有K+、NO3-和少量H+、OH-,则加入试剂顺序正确的是
| A.③①②④ | B.①③②④ | C.②①③④ | D.①②③④ |
已知25℃时,AgⅠ饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.30×10-5 mol·L-1。若在5mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是
| A.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的KSP的数值为1.69×10-10 |
| D.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol·L-1。若在5mL含有KCl和KI各为0.01 mol·L-1的溶液中,加入8mL
0.01 mol·L-1AgNO3溶液,下列叙述正确是( )
| A.混合溶液中c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-) |
| B.混合溶液中c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-) |
| C.加入AgNO3溶液时首先生成AgCl沉淀 |
D.混合溶液中 约为1.02×103 约为1.02×103 |
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
| A.所得溶液中的c(H+)=1.0×10-13 mol·L-1 |
| B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1 |
| C.所加的烧碱溶液pH=13.0 |
| D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1 |
在一混合溶液中含有KCl、KBr、K2CrO4,其浓度均为0.01 mol·L-1,向溶液中逐滴加入0.01 mol·L-1AgNO3溶液时,最先和最后沉淀的物质是( )
(AgCl、 AgBr、 Ag2CrO4的Ksp分别为1.77×10-10、5.35×10-13、1.12×10-12)
| A.AgBr、AgCl | B.Ag2CrO4、AgCl |
| C.AgBr、Ag2CrO4 | D.同时沉淀 |
已知:,
,
,则下列难溶盐的饱和溶液中,
浓度大小顺序正确的是()
| A. |
|
B. |
|
| C. |
|
D. |
|