已知Ksp(AgCl)=1.6×10-13,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
| D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 |
2.5×10-10mol/L
在常温时的下列溶液中,BaSO4的溶解度最大的是
| A.40 mL 1 mol/L的BaCl2溶液 |
| B.30 mL 2 mol/L的Ba(OH)2溶液 |
| C.10 mL纯水 |
| D.50 mL 0.1 mol/L的H2SO4溶液 |
在[Pb2+]为0.200mol/L的溶液中,若每升加入0.201mol的Na2SO4(设条件不变), 留在溶液中的Pb2+的百分率是(已知PbSO4的Ksp=1.8×10-8) ( )
| A.1×10-3% | B.2×10-4% | C.9×10-3% | D.2.5×10-20% |
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是( )
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25℃时,Mg(OH)2在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1NH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
下列推断或表述正确的是( )
| A.因为氯化铝是分子晶体,所以工业制备金属铝不采用电解氯化铝溶液,但工业制取金属镁可以采用电解氯化镁溶液的方法 |
| B.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体c(Mg2+)增大 |
| C.鸡蛋清中加入2滴1%醋酸铅溶液后会产生沉淀,因为蛋白质发生了变性。 |
| D.在BaSO4悬浊液中加入饱和碳酸钠溶液,过滤、洗涤得固体,再加盐酸产生气体。可证明Ksp(BaSO4)<Ksp(BaCO3) |
氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s) Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,可加入少量的( )
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,可加入少量的( )
| A.NaOH | B.NH4Cl | C.MgSO4 | D.NaHSO4 |
下列有关Ksp说法正确的是
| A.某温度下, CaSO4溶液中C(Ca2+) ·C(SO42-)就是 Ksp |
| B.25 ℃时, Fe(OH)3固体在0.01mol/LNH4Cl溶液中的溶解度增大,其Ksp也增大。 |
C.在一定条件下实现BaSO4+Na2CO3 BaCO3+ Na2SO4,说明KSP(BaSO4)>KSP(BaCO3) BaCO3+ Na2SO4,说明KSP(BaSO4)>KSP(BaCO3) |
| D.升高温度,若某沉淀溶解平衡逆向移动, Ksp也变小 |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3 主要:Cu2+ + CO32─+ H2O ="=" Cu(OH)2↓+ CO2↑
次要:Cu2+ + CO32─="=" CuCO3↓
(2) CuSO4 +Na2S 主要:Cu2+ + S2─="=" CuS↓
次要:Cu2+ + S2─+ 2H2O ="=" Cu(OH)2↓+ H2S↑
下列几种物质的溶解度大小的比较中,正确的是 ( )
| A.CuS <Cu(OH)2<CuCO3 | B.CuS >Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2<CuCO3<CuS |
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42× 10-11。下列说法正确的是( )
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01mol/L NH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后, Mg(OH)2不可能转化为MgF2 |
.常温下,下列有关叙述正确的是( )
| A.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol/L |
| B.Na2CO3溶液中,2c(Na+)=c(CO)+c(HCO)+c(H2CO3) |
| C.pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH)大小顺序为:①>②>③ |
| D.10 mL pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,则所得溶液体积V(总)=20 Ml |
下列液体均处于25℃,有关叙述不正确的是( )
| A.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| B.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同 |
| D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是
| A.a、c两点均可以表示常温下CaS04溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
| C.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
氯化银在水中存在AgCl(s) 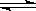 Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是
Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是
| A.①②③④ | B.③④①② | C.①②④③ | D.③④②① |
某温度下,水的离子积常数K 。该温度下,将pH=4的
。该温度下,将pH=4的 溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
| A.1∶10 | B.9∶1 | C.1∶9 | D.99∶21 |