已知25℃时,Mg(OH)2的溶度积常数Ksp = 5.6×10-12,MgF2的溶度积常数Ksp = 7.4×10-11。下列说法正确的是
| A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| B.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大 |
| C.25℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp相比较,前者小 |
| D.25℃时,在Mg(OH)2的悬浊液中加入饱和NaF溶液后,Mg(OH)2不可能转化成MgF2 |
下列对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的原因解释中正确的有
①Mg(OH)2的Ksp大于MgCO3的Ksp,且在水中发生了沉淀转化
②Mg(OH)2的Ksp小于MgCO3的Ksp,且在水中发生了沉淀转化
③MgCO3电离出的CO32-发生水解,使水中c(OH-)减小,对Mg(OH)2的沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
④MgCO3电离出的CO32-发生水解,使水中c(OH-)增大,对Mg(OH)2的沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀
| A.①② | B.②④ | C.③④ | D.②③ |
工业品MnCl2溶液中含有cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2。由此可推知MnS
| A.溶解度大于CuS、PbS |
| B.溶解度小于CuS、PbS |
| C.溶解度与CuS、PbS相同 |
| D.无法确定MnS与CuS、PbS溶解度的相对大小 |
常温下,AgCl、AgBr、AgI的溶度积(Ksp)依次为1.8×10 、5.0×10
、5.0×10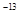 、8.3×10
、8.3×10 。下列有关说法错误的是 ( )
。下列有关说法错误的是 ( )
| A.常温下在水中溶解能力AgCl>AgBr>Agl |
| B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成 |
| C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCI沉淀生成 |
| D.在AgI饱和液中加入NaI固体有AgI沉淀析出 |
某温度下重水(D2O)的离子积常数为1.6×10-15,用定义pH一样来规定
pD=-lg{c(D+)},则该温度下,下列叙述正确的是
| A.纯净的重水(D2O)中,pD=7 |
| B.1 L溶解有0.01 mol DCl的重水溶液,其pD=12.0 |
| C.纯净的重水中,c(D+)=c(OD-) |
| D.1 L溶解有0.01 mol NaOD的重水溶液,其pD=12.0 |
下列说法正确的是
| A.将AlCl3溶液蒸干并灼烧后得到的物质是Al(OH)3 |
| B.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| D.所谓沉淀完全就是用沉淀剂将溶液中某一离子除净; |
已知Ag2SO4的KSP=c2(Ag+)× c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,此时溶液中c(Ag+)=0.030 mol·L-1。若t1时刻改变条件,下图中不正确的是
牙齿表面覆盖的牙釉质是人体中最坚硬的部分,起着保护牙齿的作用,其主要成分为羟基磷酸钙[Ca5(PO4)3OH]。在牙齿表面存在着如下平衡:
Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp=6.8×10-37 mol9·L-9
5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp=6.8×10-37 mol9·L-9
下列说法错误的是
| A.残留在牙齿上的糖发酵会产生H+,经常吃糖易造成龋齿 |
| B.由上述平衡可知,小孩长牙时要少吃糖多补钙 |
| C.若减小OH-的浓度,上述平衡将向右移动,Ksp的值相应增大 |
| D.使用含氟牙膏能防止龋齿,是因为Ca5(PO4)3OH(s)转化为更难溶的Ca5(PO4)3F(s) |
[ Ca5(PO4)3F(s)的Ksp = 2.8×10-61 mol9·L-9]
在一定温度下,氯化银在水中存在如下沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq),若把AgCl分别放入①100mL0.1mol/LNa2SO4溶液中;②100mL0.1mol/L NaCl溶液中;③100mL0.1mol/L AlCl3溶液中;④100mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
Ag+(aq)+Cl-(aq),若把AgCl分别放入①100mL0.1mol/LNa2SO4溶液中;②100mL0.1mol/L NaCl溶液中;③100mL0.1mol/L AlCl3溶液中;④100mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
| A.①>②>④>③ | B.②>①>④>③ | C.④>③>②>① | D.①>④>③>② |
t℃时,水的离子积为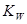 ,该温度下将a mol?L-1一元酸HA与b mol?L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
,该温度下将a mol?L-1一元酸HA与b mol?L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
| A.混合液的pH=7 | B.混合液中c(H+)=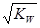 |
| C.a=b | D.混合液中c(B+)=c(A-)+c(OH-) |
将足量BaCO3粉末分别加入下列溶液中充分溶解至饱和。各溶液中Ba2+的浓度最小的为
| A.10 mL 0.2 mol/LNa2CO3溶液 | B.40 mL水 |
| C.50 mL 0.01 mol/L 氯化钡溶液 | D.100 mL 0.01 mol/L盐酸 |
将足量BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为
| A.40mL 水 | B.10mL 0.2 mol·L-1Na2CO3溶液 |
| C.50mL 0.01 mol·L-1氯化钡溶液 | D.100mL 0.01 mol·L-1盐酸 |
为了防止热带鱼池中水藻的生长,需保持水中Cu2+的浓度约1.2×10-5 mol·L-1。为避免在每次换池水时溶液浓度的改变,可把适当的含铜化合物放在池底,其饱和溶液提供适当的Cu2+。已知CuS、Cu(OH)2、CuCO3的Ksp值依次为1.3×10-36、2.2×10-20、1.4×10-10,下列四种物质中,能满足池水浓度要求的是
| A.CuSO4 | B.CuCO3 | C.Cu (OH)2 | D.CuS |
已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18mol2·L-2;CuS:Ksp=1.3×
10-36mol2·L-2。 下列说法正确的是
| A.同温度下,CuS的溶解度大于FeS的溶解度 |
| B.同温度下,向饱和FeS溶液中呈入少量Na2S固体后,Ksp(FeS)变小 |
| C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现 的沉淀是FeS |
| D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |