下列有关说法正确的是( )
| A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
| B.在含有BASO4沉淀的溶液中加入NA2SO4固体,C(BA2+)增大 |
| C.将纯水加热至较高温度,KW变大、pH变小、呈酸性 |
| D.锅炉中沉积的CASO4可用饱和NA2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
下列说法符合事实的是
| A.物质的量浓度相同的硫酸氢铵溶液和醋酸铵溶液中,硫酸氢铵中的铵根离子物质的量浓度较小 |
| B.在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)< Ksp(AgCl) |
| C.物质的量浓度均为0.02 mol/L的弱酸HX及其盐NaX等体积混合后:c(X—)+ c(HX)=" 0.02" mol/L |
| D.己知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12。在含C1-、CrO42-浓度相同的溶液中滴加AgNO3溶液时,首先生成Ag2CrO4沉淀。 |
下列物质的水溶液:①NaOH、②CH3COOH、③NH3,④NaHCO3、⑤Cl2,不能溶解CaCO3的是
| A.①③④ | B.①④⑤ | C.②④ | D.②⑤ |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如右图所示。下列说法正确的是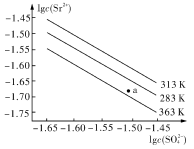
| A.温度一定时,KSP(SrSO4)随c(SO42-)的增大而减小 |
| B.三个不同温度中,313K时KSP(SrSO4)最大 |
| C.283K时,图中a点对应的溶液是饱和溶液 |
| D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/ c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/ c(CH3COOH)值增大,可以采取的措施是
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸 ④加水
| A.①② | B.②③ | C.③④ | D.②④ |
还原沉淀法是处理含铬(Cr2O72-和CrO42-)废水常用方法,过程如下:
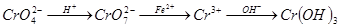 ,已知废水中Cr的含量为26.0g·L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全。常温下Ksp[Cr(OH)3]= 1×10-32。有关叙述中不正确的是( )
,已知废水中Cr的含量为26.0g·L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全。常温下Ksp[Cr(OH)3]= 1×10-32。有关叙述中不正确的是( )
| A.上述三个转化中只有一个涉及氧化还原反应 |
| B.第二步离子方程式为:Cr2O72-+14H++6Fe2+=2Cr3++7H2O+6Fe3+ |
| C.处理含铬废水可使用强碱Ba(OH)2,也可以使用弱碱氨水 |
| D.当pH≥5时,废水中铬元素沉淀完全 |
一定温度下,将0.1molAgCl固体加入1L 0.1mol·L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是 ( )
A.沉淀转化反应2AgCl(s)+ CO32-(aq) Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1 Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1 |
| B.约有2×10-5mol AgCl溶解 |
| C.反应后溶液中的:c(Na+)>c (CO32-) >c (Ag+)>c (Cl-) >c (H+) |
| D.反应后溶液中的:c(Na+)+ c (Ag+)+ c (H+)="c" (CO32-)+ c (HCO3-)+ c (Cl-) +c (OH-) |
下列叙述正确的是
| A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7] |
| C.25℃时,0. 1mo1·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
| D.0.1 mol AgCl和0. lmo1 AgI混合后加入1L水中所得溶液c(Cl-)=c(I-) |
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示,又知t ℃时AgCl的Ksp=4×10-10。下列说法不正确的是
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
下列说法中正确的是
A.AgCl悬浊液中存在平衡:AgCl(s)  Ag+(aq)+Cl-(aq),往其中加入少量NaCl固体,平衡向左移动,溶液中离子的总浓度会减小 Ag+(aq)+Cl-(aq),往其中加入少量NaCl固体,平衡向左移动,溶液中离子的总浓度会减小 |
| B.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI) |
| C.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 |
| D.硬水中含有较多的Ca2+、Mg2+、HCO3-、SO42-,加热煮沸可完全除去其中的Ca2+、Mg2+ |
下列有关说法正确的是( )
| A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| C.将纯水加热至较高温度,KW变大、pH变小、呈酸性 |
| D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
向MnCl2溶液中加入过量难溶电解质MnS,可使溶液中含有的Cu2+、Pb2+、Cd2+等金属离子转化为硫化物沉淀,从而得到纯净的MnCl2。下列分析正确的是
| A.MnS具有吸附性 |
| B.MnS有还原性,将Cu2+、Pb2+、Cd2+还原后除去 |
| C.MnS溶液度大于CuS、PbS、CdS |
| D.MnS与Cu2+反应的离子方程式是Cu2++S2-=CuS↓ |
根据20℃时某些物质的溶解度(g)数据:
| CaCO3 |
CaSO4 |
Mg(OH)2 |
MgCO3 |
| 1.4×10-3 |
2.55×10-2 |
9×10-4 |
1.1×10-2 |
下列说法不正确的是
A.硫酸钙悬浊液中存在CaSO4(s) Ca2+(aq)+ SO42-(aq)
Ca2+(aq)+ SO42-(aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向Mg(OH)2悬浊液中滴加FeCl3,沉淀变为红褐色,说明溶解度Fe(OH)3< Mg(OH)2
D.向2ml饱和MgCl2溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2
下列方程式书写正确的是
A.碳酸的电离方程式:H2CO3 2H+ + CO32- 2H+ + CO32- |
B.硫化钠水解: S2-+2H2O H2S +2OH- H2S +2OH- |
| C.往AgI悬浊液中滴加Na2S饱和溶液:2Ag+ (aq)+ S2-(aq) = Ag2S(s) |
| D.用醋酸除水垢: 2CH3COOH + CaCO3= 2CH3COO-+ Ca2++ H2O + CO2↑ |