在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)  Ca(OH)2(aq)
Ca(OH)2(aq)  Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是
| A.n(Ca2+)减小 | B.c(Ca2+)不变 | C.n(OH-)增大 | D.c(OH-)减小 |
氢氧化镁固体在水中溶解,有下列平衡:Mg(OH)2(s)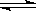 Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少
Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少
| A.Na2CO3 | B.MgCl2 | C.NH4Cl | D.NaCl |
下列说法中正确的是( )
| A.不溶于水的物质溶解度为0。 |
| B.绝对不溶解的物质是不存在的 |
| C.某离子被沉淀完全是指该离子在溶液中的浓度为0 |
| D.物质的溶解性为难溶,则该物质不溶于水 |
下列说法中不正确的是( )
| A.Ksp只与难溶电解质本身的性质和温度有关 |
| B.在一定温度下的AgCl饱和溶液中,C(Ag+)和C(Cl-)的乘积是一个常数 |
| C.在一定温度下,向AgCl饱和溶液中加入盐酸时,Ksp值变大 |
| D.由于Ksp(FeS)>Ksp(CuS),所以FeS沉淀在一定条件下可以转化为CuS沉淀 |
将足量AgCl分别放入:①5ml水②10ml0.2 mol·L-1MgCl2溶液③20ml0.5 mol·L-1NaCl溶液④40ml0.1 mol·L-1盐酸中溶解至溶液饱和,各溶液Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是
| A.a>b>c>d | B.d>b>c>a | C.a>d>b>c | D.c>b>d>a |
在100ml 0.01mol/LKCl溶液中,加入1ml0.01mol/LAgNO3溶液,下列说法正确的是(已知AgCl的Ksp=1.8×10-10) ( )
A.有AgCl沉淀析出  |
B.无AgCl沉淀析出 |
| C.有沉淀析出,但不是AgCl | D.无法确定是否有沉淀析出 |
向AgCl饱和溶液中加水,下列叙述正确的是 ( )
| A.AgCl的溶解度增大 | B.AgCl的溶解度、Ksp均不变 |
| C.AgCl的Ksp增大 | D.AgCl的溶解度、Ksp均增大 |
已知相同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2,就溶解或电离出S2-的能力而言:FeS>H2S>CuS,则下列离子方程式错误的是
A.Zn2++S2-+2H2O=Zn(O H)2↓+H2S↑ H)2↓+H2S↑ |
B.Mg2++2HCO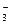 +2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O +2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
| C.FeS+2H+=Fe2++H2S↑ |
| D.Cu2++H2S=CuS↓+2H+ |
已知25℃时BaSO4饱和溶液中存在BaSO4(s) Ba2+(aq)+SO(aq),
Ba2+(aq)+SO(aq),
Ksp=1.1025×10-10,下列有关BaSO4的溶度积和溶解平衡的叙述正确的是( )
| A.25℃时,向c(SO)=1.05×10-5mol/L的BaSO4溶液中,加入BaSO4固体,c(SO)增大 |
| B.向该饱和溶液中加入Ba(NO3)2固体,则BaSO4的溶度积常数增大 |
| C.向该饱和溶液中加入BaCl2固体,则该溶液中c(SO)减小 |
| D.向该饱和溶液中加入Na2SO4固体,则该溶液中c(Ba2+)>c(SO) |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3 主要: Cu2+ + CO32─ + H2O = Cu(OH)2↓ + CO2↑
次要:Cu2+ + CO32─= CuCO3↓(几乎不发生反应。下同)
(2) CuSO4 +Na2S 主要: Cu2+ + S2─ =" " CuS↓
次要: Cu2+ + S2─ + 2H2O = Cu(OH)2↓ + H2S↑
则下列几种物质的溶解度大小的比较中,正确的是( )
| A.CuS <Cu(OH)2<CuCO3 | B.CuS >Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2<CuCO3<CuS |
已知下列反应:①NH3+H+=NH4+ ②Ag++2NH3=Ag(NH3)2+ ③Ag++Cl-=AgCl
前者都比后者更容易发生。下列事实或现象预期错误的是
| A.氯化银可溶于氨水 | B.银氨溶液中加入氯化钠溶液有白色沉淀 |
| C.银氨溶液中加入盐酸有白色沉淀 | D.银镜反应的残留液可用稀硝酸处理 |
下列各溶液中,Na+浓度最大的是 ( )
| A.0.8L0.4mol/L的NaOH溶液 | B.0.2L0.15mol/L的Na3PO4溶液 |
| C.1L0.3mol/L的NaCl溶液 | D.0.4L0.5mol/L的NaCl溶液 |
向5mLNaCl溶液里滴 入一滴AgNO3溶液,出现白色沉淀,继续加入一
入一滴AgNO3溶液,出现白色沉淀,继续加入一 滴KI溶液,沉淀变为黄色,再加入一滴Na2S溶液,沉淀又变为黑色,据此分析此三种沉淀物的KSP的一般关系为()
滴KI溶液,沉淀变为黄色,再加入一滴Na2S溶液,沉淀又变为黑色,据此分析此三种沉淀物的KSP的一般关系为()
| A.KSP(AgCl)=KSP(AgI)=KSP(Ag2S) | B.KSP(AgCl)<KSP(AgI)<KSP(Ag2S) |
| C.KSP(AgCl)>KSP(AgI)>KSP(Ag2S) | D.因发生特殊反应,无法判断 |
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-13mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1
C.镁铝合金5.1g溶于300mL2mol/LHCl溶液时,在标准状况下产生气体5.6L。若向反应后的溶液中加入过量烧碱溶液,则产生沉淀的质量为A.5.8gB.7.8gC.10.4gD.13.6g加的烧碱溶液pH=13.0
D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1