有关难溶盐的溶度积及溶解度,以下叙述中正确的是
| A.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子浓度的乘积就是该物质的Ksp |
| B.两种难溶电解质,其中Ksp小的溶解度也一定小 |
| C.加入与原电解质具有相同离子的物质,可使难溶盐电解质的溶解度变小,也使Ksp变小 |
| D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变 |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.8×10-13。现将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为
| A.只有AgBr沉淀 |
| B.AgCl和AgBr沉淀等量生成 |
| C.AgCl和AgBr沉淀都有,AgCl沉淀比AgBr多 |
| D.AgCl和AgBr沉淀都有,AgBr沉淀比AgBr多 |
下列说法中正确的是
| A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 |
B.AgCl悬浊液中存在平衡:AgCl(s)  Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 |
| C.为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 |
| D.硬水中含有较多的Ca2+、Mg2+、HCO3-、SO42-,加热煮沸可以完全除去其中的 Ca2+、Mg2+ |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
| A.温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
在重铬酸钾(K2Cr2O7)溶液中存在如下平衡:

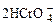

 , 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
, 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
| A.Ag2O | B.Ag2CrO4 | C.AgHCrO4 | D.Ag2Cr2O7 |
把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)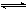 Ca2++2OH-
Ca2++2OH-
当向悬浊液中加入少量生石灰后,若温度保持不变,下列说法正确的是( )
| A.溶液中Ca2+数目增多 | B.溶液中Ca2+数目不变 |
| C.c(Ca2+)增大 | D.c(Ca2+)不变 |
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是 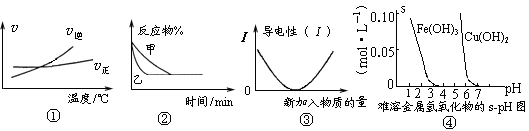
A.根据图①可判断可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH>0 2AB3(g)”的ΔH>0 |
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右 |
下列说法正确的是
| A.AgCl的水溶液中,Ag+和Cl-浓度的乘积是一个常数; |
| B.AgCl的Ksp=1.8×10-10,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10; |
| C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液; |
| D.向饱和AgCl水溶液中加入盐酸,Ksp值变大。 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。
下列说法正确的是
| A.CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
C.d点溶液通过蒸发 可以变到c点 可以变到c点 |
| D.a点对应的Ksp等于c点对应的Ksp |
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
一定温度下,难溶电解质AmBn在水中溶解平衡的溶度积为Ksp=cm(An+)×cn(Bm-)。25℃,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,先出现黄色沉淀,最终生成黑色沉淀。已知有关物质的颜色和溶度积如下:
| 物质 |
AgCl |
AgI |
Ag2S |
| 颜色 |
白 |
黄 |
黑 |
| Ksp(25℃) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列叙述不正确的是( )
| A.溶度积小的沉淀可以转化为溶度积更小的沉淀 |
| B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 |
| C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 |
| D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 |
下列对各种平衡体系的叙述中,完全正确的是一组是 ( )
①醋酸溶液中存在的电离平衡:CH3COOH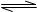 CH3COO-+H+,加水稀释后,溶液中所有离子浓度均减小;
CH3COO-+H+,加水稀释后,溶液中所有离子浓度均减小;
②常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡逆向移动;
③某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g)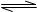 2Z(g)+W(s); △H>0平衡后,升高温度,该化学平衡正向移动;
2Z(g)+W(s); △H>0平衡后,升高温度,该化学平衡正向移动;
④在上述③的可逆反应中,当容器中气体压强不变时,反应达到平衡;
⑤一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:
CH3COO-+H2O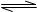 CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
⑥在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动
⑦在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
| A.①②③④⑤ | B.②③④⑤⑥ | C.②③⑤⑥⑦ | D.①②⑤⑥⑦ |
25℃时,在BaSO4的饱和溶液中存在:BaSO4(s)? Ba2+(aq)+SO42-(aq),Ksp=1.1025×10-10,在该温度下有关BaSO4的溶度积和溶解平衡的叙述正确的是 ( )
| A.向c(SO42-)=1.05×10-5mol/L的BaSO4溶液中加入BaSO4固体,c(SO42-)增大 |
| B.向该饱和溶液中加入Ba(NO3)2固体,则BaSO4的溶度积常数增大 |
| C.向该饱和溶液中加入Na2SO4固体,则该溶液中c(Ba2+)>c(SO42-) |
| D.向该饱和溶液中加入BaCl2固体,则该溶液中c(SO42-)减小 |
已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是
| A.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的KsP的数值为1.69×10-10 |
| D.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |