内蒙古赤峰平煤高中高三第一次学情测试化学卷
下列叙述正确的是 ( )
| A.P4和NO2都是共价化合物 |
| B.CCl4和NH3都是以极性键结合的极性分子 |
| C.在CaO和SiO2晶体中都不存在单个小分子 |
| D.甲烷是对称平面结构,是非极性分子 |
下列有关钠的叙述中错误的是( )
| A.电解法冶炼金属钠时,钠在阳极析出 |
| B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 |
| C.钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
| D.钠的质地软,可用小刀切割 |
下列关于热化学反应的描述中正确的是 ( )
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(—57.3)kJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程为 CO(g)+1/2O2(g)="=" CO2(g);△H=—283.0kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热 |
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是 ( )
| A.p(Ne)>p(H2)>p(O2) | B.p(O2)>p(Ne)>p(H2) |
| C.p(H2)>p(O2)>p(Ne) | D.p(H2)>p(Ne)>p(O2) |
下列反应中生成物总能量高于反应物总能量的是( )
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |
在一定温度下,向饱和的烧碱溶液中放入一定量的Na2O2,充分反应后恢复到原来的温度。下列说法中正确的是( )
| A.溶液中OH-总数不变,有O2放出 |
| B.溶液中Na+的物质的量浓度增大,有O2放出 |
| C.溶液中Na+总数减少,有O2放出 |
| D.溶液pH增大,有O2放出 |
铊盐与氰化钾被列为A级危险品,铊(Tl)与铝同主族,原子序数为81,Tl3+与Ag在酸性介质中发生反应:Tl3+ + 2Ag =Tl+ +2Ag+ 且已知 Ag+ +Fe2+ =" Ag" + Fe3+ 则下列推断正确的是( )
| A.Tl+最外层有3个电子 | B.氧化性:Tl3+ >Ag+>Fe3+ |
| C.还原性:Tl+ >Ag | D.铊位于第五周期IIIA族 |
向盛有Cl2的三个集气瓶甲、乙、丙中各加入下列液体中的一种,经振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是 ( )
| A.①②③ | B.②①③ | C.③②① | D.①③② |
以下对化学反应知识的归纳和总结中,正确的是( )
| A.酸跟活泼金属反应一定生成盐和氢气 | B.碱能跟一切非金属氧化物反应 |
| C.单质和化合物的反应一定是置换反应 | D.置换反应不一定要在溶液中进行 |
Na3N是离子化合物,它和水作用可产生NH3,下列说法正确的是( )
| A.Na+和N3-的电子层结构都与氩原子相同 |
| B.Na3N与盐酸反应可生成两种盐 |
| C.Na+的半径大于N3-的半径 |
| D.Na3N和水反应时,Na3N是还原剂 |
下列说法中正确的是( )
| A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子 |
| B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向移动 |
| C.分子晶体的熔沸点很低,常温下都呈液态或气态 |
| D.原子晶体中的各相邻原子都以共价键相结合 |
NA代表阿伏加德罗常数,下列叙述错误的是( )
| A.一定温度下,1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液含NH4+物质的量不同 |
| B.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 |
| C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
下列各组离子在指定条件下,一定能大量共存的是
| A.使石蕊试液变红色的溶液中:K+、Na+、CO32- 、NO3- |
B.在酸性高锰酸钾溶液中: |
C. 的溶液中: 的溶液中: |
D.水电离出的 的溶液中: 的溶液中: |
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-13mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1
C.镁铝合金5.1g溶于300mL2mol/LHCl溶液时,在标准状况下产生气体5.6L。若向反应后的溶液中加入过量烧碱溶液,则产生沉淀的质量为A.5.8gB.7.8gC.10.4gD.13.6g加的烧碱溶液pH=13.0
D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以离子的形式存在。实验中从海藻提取碘的流程图如下: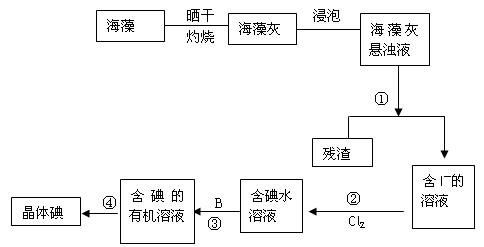
(1)指出提取碘的过程中有关的实验操作名称① 写出过程②中有关反应的离子方程式:
(2)提取碘的过程③中可选择的有机试剂为
| A.酒精、四氯化碳 | B.四氯化碳、苯 |
| C.汽油、醋酸 | D.汽油、甘油 |
(3)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
(4)在过程④的操作中发现晶体碘大量附着在烧瓶内壁上,是由于碘具有 性质
如图,将铜片和锌片焊接在一起组成A电极,B为碳棒进行电解实验,电解液中含硝酸银和硝酸铜各0.1 mol。已知电路中通过0.2 mol电子。
(1)请写出A.B两极发生反应的电极反应式A: B:
(2)请分析A.B两极质量变化情况为A: B:
(1)配平氧化还原反应方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++ H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为 mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由 变为 。该溶液中还原剂的物质的量为 mol。
在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2, X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子.
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的电子式是 .
(2)元素D.E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 .
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为 .
硫化钠和碳酸钠为原料、采用下述装置制备硫代硫酸钠,制备反应可表示为:
2Na2 S +Na2CO3 + 4SO2= 3Na2S2O3 +CO2。根据要求回答问题:
(1)实验时,打开K1,关闭K2,最后洗气瓶中发生反应的离子方程式是 。
(2)锥形瓶内溶液pH小于7时会导致产品分解,因此实验过程中需要控制锥形瓶内溶液的pH。
①反应过程中,锥形瓶中溶液pH将________(填“增大”、“减小”或“保持不变”)。
②测量锥形瓶中溶液pH时,用注射器吸取溶液样品比直接打开锥形瓶中瓶塞取样,除操作简便外,还具有的优点是 。
③若实验过程中测得溶液pH已接近于7。此时应该进行的操作是 。
(3)已知:2Na2 S2O3 +I2="2NaI+" Na2 S4O6。实验结束后进行相关处理,可即获得Na2 S2O3 ·5H2O晶体。为测量其纯度,取晶体样品mg,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液vmL,则该样品纯度是 。
(4)制取硫代硫酸钠的另一种方法是直接将硫粉和亚硫酸钠、水混合共热制取。为探究制取硫代硫酸钠最佳条件(溶液pH、亚硫酸钠浓度、反应温度、硫粉质量),设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
①实验1、2的目的是探究亚硫酸钠浓度对亚硫酸钠转化率的影响,则a=
②若还要探究溶液pH、反应温度、硫粉质量对亚硫酸钠转化率的影响,除实验1、2外,至少还需进行 次对比实验
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响。为什么?
答:________________________________________ ___。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号