工业上向锅炉里注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3而后用盐酸去除。下列叙述不正确的是
| A.温度升高,Na2CO3溶液的Kw和c(OH一)均会增大 |
| B.沉淀转化的离子方程式为CO32-+CaSO4=CaCO3+SO42- |
| C.盐酸溶液中,CaCO3的溶解性大于CaSO4 |
| D.Na2CO3溶液遇CO2后,阴离子浓度均减小 |
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质,并用来生产ZnSO4 ·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的 pH 如下表。

| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Cu(OH)2 |
| 开始沉淀的 pH |
3.3 |
1.5 |
6.5 |
5.4 |
4.2 |
| 沉淀完全的 pH |
5.2 |
3.7 |
9.7 |
8.0 |
6.7 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有____________。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是______________。为使 Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为__________________。为控制上述pH范围可选择加入的试剂或药品是 。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)常温下,已知 Ksp[Zn(OH)2]=5×10-17,某 ZnSO4溶液里c(Zn2+)=0.5mol/L,如果要生成Zn(OH)2沉淀,则应调整溶液 pH 大于_______________。
(4)当向含相同浓度Cu2+、Fe3+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]________Ksp[Cu(OH)2](填“>”、“=”或“<”)
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12 mol•L-1,,K[MgF2]=7.43×10-11.下列说法正确的是
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol•L-1氨水中的Ksp比在20 mL 0.01 mol•L-1NH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。则原溶液中c(Br-)/c(Cl-)的比值约为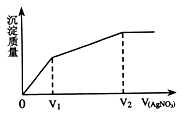
| A.V1/(V2-V1) | B.V1/V2 | C.(V2-V1)/V1 | D.V2/V1 |
化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+FeS(s) CuS(s)+Fe2+(aq)下列有关叙述中正确的是( )
CuS(s)+Fe2+(aq)下列有关叙述中正确的是( )
①FeS的Ksp大于CuS的Ksp
②该反应平衡常数K=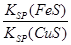
③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变
④达到平衡时c(Fe2+)=c(Cu2+)
| A.②③ | B.①③④ | C.①② | D.②③④ |
欧盟定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6
kJ热量。该反应的热化学方程式: 。
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
 物质 物质T/℃ n/mol |
活性炭 |
NO |
E |
F |
| 初始 |
2.030 |
0.100 |
0 |
0 |
| T1 |
2.000 |
0.040 |
0.030 |
0.030 |
| T2 |
2.005 |
0.050 |
0.025 |
0.025 |
①写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数为 K1,T2℃时的平衡常数为 K2。
Ⅰ.K1 = 。(列式并计算)
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有很高的发电效率,因而受到重视,该电池用 Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO 为阳极燃气,空气与 CO2的混合气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO-4e—+ 2CO32— =4CO2,则阴极反应式为: 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12。下列关于该温度下的叙述正确的是:
| A.向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl) 减小 |
| B.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| C.若向0.0008 mol·L-1的K2CrO4溶液中加入等体积0.002 mol·L-1的AgNO3溶液,则CrO42-完全沉淀(提示:沉淀完全c(CrO42-)≤10-5 mol·L-1) |
| D.若将0.001 mol·L-1 AgNO3溶液滴入浓度均为0.001 mol·L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
下列有关电解质溶液中粒子浓度关系正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中正确的是
| A.BaCO3可以转化为BaSO4,反过来则不行 |
| B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 |
| C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) = Ksp(BaCO3) / Ksp(BaSO4) |
| D.常温下,BaCO3固体若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度须大于2.2×10-6 mol·L-1 |
已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1L 0.2mol·L-1 HF溶液中加入1L 0.2mol·L-1 CaCl2溶液,则下列说法中,正确的是
| A.25℃时,0.lmol·L-1 HF溶液中pH=l |
| B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中没有沉淀产生 |
| D.该体系中HF与CaC12反应产生沉淀 |
镁是一种重要的金属资源,在工业上用途广泛。回答下列问题:
(1)已知某温度下Mg(OH)2的Ksp = 6.4×l0-12,当溶液中c(Mg2+) ≤1.0×10-5mol/L可视为沉淀完全,则此温度下应保持溶液中c(OH-) ≥ ______mol·L-1。
(2)已知常温下CH3COOH的电离常数为:Ka = l.75×10-5mol/L;NH3·H2O的电离常数为,Kb =1.76×l0-5mol/L。A.NH4Cl溶液显酸性,原因是_________________________(用离子方程式表示),NH4Cl溶液中所有离子的浓度由大到小的顺序为_________________________;
B.CH3COONH4溶液显___________ (填“酸”、“碱”或“中”)性。
C.将饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,可看到白色沉淀溶解。产生这种现象的原因存在以下两种观点。
观点①:2NH4+ + Mg(OH)2= 2NH3·H2O+ Mg2+ ;
观点②的离子方程式为_________________________。
要验证①和②谁是Mg(OH)2溶解的主要原因,可选取______________(填序号)代替NH4Cl溶液作对照实验。
a. NH4NO3 b. (NH4)2SO4 c. CH3COONH4 d. NH4HSO4
可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10,下列推断正确的是
| A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4) |
| B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 |
| C.若误饮c(Ba2+)=1.0×10-5 mol/L的溶液时,会引起钡离子中毒 |
| D.可以用0.36 mol/L的Na2SO4溶液给钡离子中毒患者洗胃 |
25 ℃时几种难溶电解质的溶解度如表所示:
| 难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
| 沉淀完全时的pH |
11.1 |
6.7 |
9.6 |
3.7 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为__________(填化学式)而除去。
(2)①中加入的试剂应该选择_____________________。
(3)②中除去Fe3+所发生的离子方程式为____ 。
(4)下列与方案③相关的叙述中,正确的是_____________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
| 模拟海水中的离 子浓度(mol/L) |
Na+ |
Mg2+ |
Ca2+ |
Cl― |
 |
| 0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。 下列说法正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
已知Cr(OH) 3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。 具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr2O 与FeSO4溶液在酸性条件下反应的离子方程式__________________。
与FeSO4溶液在酸性条件下反应的离子方程式__________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂最好为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式,并简要写出能生成Ag2CrO4沉淀原因的计算过程。