已知Cr(OH) 3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。 具体流程如下:
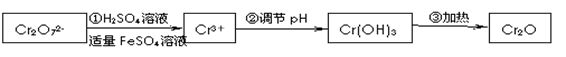
有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr2O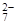 与FeSO4溶液在酸性条件下反应的离子方程式__________________。
与FeSO4溶液在酸性条件下反应的离子方程式__________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂最好为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式,并简要写出能生成Ag2CrO4沉淀原因的计算过程。
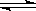 N2O4(g)
N2O4(g) 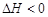
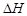 分别为-285.8 kJ·mol-1 、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
分别为-285.8 kJ·mol-1 、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题: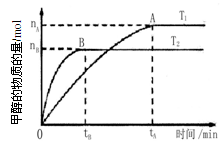
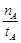 mol·L-1·min-1
mol·L-1·min-1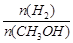 增大
增大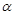 ,则容器内的压强与起始压强之比为.
,则容器内的压强与起始压强之比为. PCl3(g)+Cl2(g); △H1>0 K1=1mol·L—1
PCl3(g)+Cl2(g); △H1>0 K1=1mol·L—1 COCl2(g);△H1<0 K2=5×104L·mol—1
COCl2(g);△H1<0 K2=5×104L·mol—1 粤公网安备 44130202000953号
粤公网安备 44130202000953号