已知25℃时,AgCl的溶度积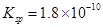 ,则下列说法正确的是:
,则下列说法正确的是:
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有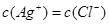 |
C.温度一定时,当溶液中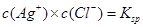 时,此溶液中必有AgCl的沉淀析出 时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI |
下列说法中,正确的是
| A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止 |
| B.Ksp越小,难溶电解质在水中的溶解能力一定越弱 |
| C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关 |
| D.相同温度下, AgCl在水中的溶解能力与在NaCl溶液中的相同 |
硼酸在玻璃制造和医药领域应用广泛。硼酸(H3BO3)溶液中存在如下电离过程:
H3BO3(aq)+H2O(l) 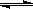 [B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)。下列有关硼酸的说法不正确的是( )
[B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)。下列有关硼酸的说法不正确的是( )
| A.25℃时0.7mol·L–1硼酸溶液中H+的浓度为2.0×10–5mol·L—1。 |
| B.硼酸与NaOH反应的离子方程式为H3BO3+OH–= [B(OH)4]–。 |
| C.碳酸钠溶液滴入硼酸中能观察到有气泡产生(已知碳酸的电离常数:K1=4.4×10—7、K2=4.7×10—11) |
| D.等物质的量浓度的Na[B(OH)4]溶液和CH3COONa溶液的pH:前者>后者(已知酸酸的电离常数K=1.75×10—5) |
下列各项中的两个量,其比例为2:1的是( )
| A.pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 |
| B.同温度下,0.2mol/LCH3COOH溶液与0.1mol/L CH3COOH溶液中的c(H+)之比 |
| C.液面在“0”刻度,50mL酸式滴定管和25mL酸式滴定管内所盛溶液的体积 |
| D.0.2mol/L的NaHSO3溶液中的阳离子与阴离子的浓度之比 |
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/ c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/ c(CH3COOH)值增大,可以采取的措施是
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸 ④加水
| A.①② | B.②③ | C.③④ | D.②④ |
某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是( )
①有晶体析出 ②c(Ca(OH)2)增大 ③pH不变
④c(H+)·c(OH-)的乘积不变 ⑤c(H+)一定增大
| A.① | B.①③ | C.①②④ | D.①⑤ |
20℃时H2S饱和溶液1 L,其浓度为0.1 mol / L,若要使溶液的pH和c(S2-)减小,可采取的措施是 ( )
| A.加入适量的CuSO4固体 | B.加入少量的氢氧化钠固体 |
| C.通入适量的H2S气体 | D.加入适量水 |
将足量BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为:
| A.40mL 水 | B.10mL 0.2mol/LNa2CO3溶液 |
| C.50mL 0.01mol/L 氯化钡溶液 | D.100mL 0.01mol/L盐酸 |
向含1 mol KAl(SO4)2的溶液中逐滴加入2 mol Ba(OH)2溶液,下列说法中正确的是
| A.先生成沉淀,后沉淀全部溶解 |
| B.最后的沉淀为2 mol BaSO4、1 mol Al(OH)3 |
| C.当溶液中SO42-全部沉淀出来时,沉淀的总质量最大 |
| D.当溶液中Al 3+ 全部沉淀出来时,沉淀的总质量最大 |
I. H2A在水中存在以下平衡:H2A  H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为 。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是______________。
| A.c(Na+ )>c(K+ ) | B.c(H +)•c(OH )=1×10-14 |
| C.c(Na+ )=c(K+ ) | D.c(Na+ )+c(K+ )=c(HA- )+c(A2-) |
Ⅱ.含有Cr2O72- 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L Cr2O72-。为使废水能达标排放,作如下处理:

(3)该废水中加入FeSO4•7H2O和稀硫酸,发生反应的离子方程式为: 。
(4)欲使25 L该废水中Cr2O72- 转化为Cr3+,理论上需要加入_________g FeSO4•7H2O。
(5)若处理后的废水中残留的 c(Fe3+)=1×10-13mol/L ,则残留的 Cr3+的浓度为_________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol,/L ,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
III.已知:I2+2S2O32-==2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
(6)步骤c中判断恰好反应完全的现象为
(7)根据以上实验和包装袋说明,所测精制盐的碘含量是 mg/kg。(以含w的代数式表示)
工业品MnCl2溶液中含有Cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2。由此可推知MnS( )
| A.具有吸附性 | B.溶解度小于CuS、PbS |
| C.溶解度与CuS、PbS相同 | D.溶解度大于CuS、PbS |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的难溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 |
常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
| A.同物质的量浓度的三种溶液的pH:a>b>c |
| B.同pH时,三种溶液稀释相同倍数后,pH:a<b<c |
| C.同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c |
| D.同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
t℃时,水的离子积为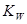 ,该温度下将a mol?L-1一元酸HA与b mol?L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
,该温度下将a mol?L-1一元酸HA与b mol?L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
| A.混合液的pH=7 | B.混合液中c(H+)=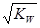 |
| C.a=b | D.混合液中c(B+)=c(A-)+c(OH-) |