影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 |
现 象 |
结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼, 反应速率越快。 |
(1)该同学的实验目的是 ;
要得出正确的实验结论,还需控制的实验条件是 。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品可以是(从题中所给药品中挑选) ;
实验二:
已知: 2KMnO4+5H2C2O4+3H2SO4 = K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
某学习小组,用稀HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.00 mL、大理石用量为10.00 g。
实验设计如表:
| 编号 |
T/K |
大理石规格 |
HNO3浓度 |
| ① |
298 |
粗颗粒 |
2.00 mol·L-1 |
| ② |
298 |
粗颗粒 |
1.00 mol·L-1 |
| ③ |
308 |
粗颗粒 |
2.00 mol·L-1 |
| ④ |
298 |
细颗粒 |
2.00 mol·L-1 |
将相应的实验目的填入下列空格中:
(1)实验①和②探究 对该反应速率的影响;
(2)实验①和③探究 对该反应速率的影响;
(3)实验①和④探究 对该反应速率的影响
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ,
t2~t3速率变化的主要原因是 。
(2)实验②放出氢气的量减少的原因是 。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。
请选择下列相应的a或b作答。
a.若不正确,请说明原因:
b.若正确则写出实验③中原电池的正、负极电极反应式。
某同学对MnO2、CuO、Fe2O3、Cr2O3在氯酸钾受热分解反应中的催化作用进行了研究。实验所得数据如下表。就本实验的有关问题,请填空:
| 实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) (已折算为标况) |
耗时(s) |
||
| 化学式 |
质量(g) |
实际回收 |
||||
| 1 |
0.6 |
— |
— |
— |
10 |
480 |
| 2 |
0.6 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
| 3 |
0.6 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
| 4 |
0.6 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
| 5 |
0.6 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
(1)本实验的装置由下图三部分组成,其正确的接口连接顺序为 。
(2)为证明编号2的实验中MnO2起到催化作用,上述实验后还要测定反应剩余物MnO2的质量,实验的操作顺序是:溶解→ → → → 。
(3)从上表实验数据分析,对氯酸钾受热分解有催化作用的物质,按其催化能力从大到小的顺序为 (填物质的化学式)。
(4)从编号3的实验数据,可计算出KClO3的分解率为 %(保留一位小数)。
(5)在进行编号5的实验时,有刺激性的黄绿色气体产生,该气体可能是______(填化学式),常用 试纸检验该气体,上述异常现象产生的原因是 。
某实验小组对H2O2的分解做了如下探究:
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:
用10ml H2O2制取150ml(标准状况下)O2所需的时间(s)
| 反应条件 时间(s) 反应条件 时间(s) 浓度 |
30%H2O2 |
15%H2O2 |
10%H2O2 |
5%H2O2 |
| 无催化剂、不加热 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
| 无催化剂、加热 |
360 |
480 |
t |
720 |
| MnO2催化剂、加热 |
10 |
25 |
60 |
120 |
①该实验小组在设计方案时,考虑了浓度、 、 等因素对H2O2分解速率的影响。 ②推测t的范围为 。
②推测t的范围为 。
(2)将质量相同但聚集状态不同的MnO2分别加入15 ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
| 催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5min |
| 块状 |
反应较慢,火星红亮但木条未复燃 |
30min |
①写出上述实验中发生反应的化学方程式:
②实验结果表明,催化剂的催化效果与 有关。
用纯净的块状的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断:______段化学反应速率最快,_______段收集的二氧化碳气体最多。
(2)上述反应中,A g块状碳酸钙跟足量盐酸反应,反应物消耗的质量随时间的变化曲线由实线表示,在相同的条件下,将B g (A>B)粉末状碳酸钙与足量的同浓度盐酸反应,反应物消耗的质量随时间的变化曲线由虚线表示。则最符合实际情况的图像是________
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是_________.
A.蒸馏水 B.氯化钠 C.硝酸钾溶液 D.浓盐酸 E.降温 F加入MnO2
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
| 实验编号 试剂 |
A |
B |
C |
| 10% H2O2/mL |
20.0 |
V1 |
V2 |
| 2mol/L FeCl3/ mL |
0 |
5.0 |
10.0 |
| H2O/ mL |
V3 |
V4 |
0 |
按要求回答下列问题:
(1)欲用右图装置来比较该反应的反应速率快慢,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测 推(计)算反应速率。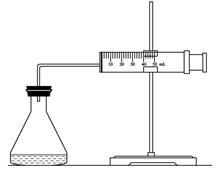
(2)为实现实验目的,则V1= ,V2= ;
V3= ,V4= 。
(3)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填“实验编号”)
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 ==2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:
。
某化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<)且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。
某化学反应2A (g)  B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如下表:
B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如下表:
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是 min,实验4达到平衡的时间是 min.
(2)C1 C2(填“大于”“小于” “等于”);C3= mol•L-1
(3)实验4比实验1的反应速率 (填“快”或“慢”),原因是
(4)如果2A (g)  B(g) + D(g) 是一个放热反应,那么实验4与实验1相比, 放出的热量多,理由是 。
B(g) + D(g) 是一个放热反应,那么实验4与实验1相比, 放出的热量多,理由是 。
某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
| ② |
|
|
|
|
| ③ |
|
粗颗粒 |
|
|
| ④ |
|
|
|
(2)实验①中CO2质量随时间变化的关系见下图:依据反应方程式 CaCO3+HNO3
CaCO3+HNO3
 Ca(NO3)2+
Ca(NO3)2+ CO2↑+
CO2↑+ H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
某同学用相同质量的锌和相同浓度足量的稀盐酸反应得到实验数据如下
| 实验编号 |
锌的状态 |
反应温度/℃ |
收集100mL氢气所需时间 |
| ① |
薄片 |
15 |
200 |
| ② |
薄片 |
25 |
90 |
| ③ |
粉末 |
25 |
10 |
(1)该实验的目的是研究 、 对锌和稀盐酸反应速率的影响。
(2)实验①和②表明 ;
(3)能表明固体的表面积对反应速率影响的实验编号是 和 。
(4)要加快该反应速率,除了上述表中的因素外,你试举出两条 。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反
应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 |
现 象 |
结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
(1)该同学的实验目的是________________________________;
要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是______;应该测定的实验数据是____________________________。
(3)在使用铁与稀硫酸反应制氢气时,实验室里选择粗铁比纯铁效果更好,原因是: 。
(10分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1) 定性分析:如图甲可通过观察____________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________________________________________________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式
____________________________________________________________________。
(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是___________________________________________________________。
检查乙装置气密性的方法是
____________________________________________________________________。
(3) 0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),则前2 min内,用X的物质的量浓度变化表示的平均反应速率为________;2 min末时Y的物质的量浓度为________;化学方程式中,Z的化学计量数n=________。
(4) 在一定温度下,反应:2A(s)+2B(g)  C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
| A.容器内的压强不随时间而变化 |
| B.混合气的密度不再随时间而变化 |
| C.A的质量不再改变 |
| D.平衡混合气体的平均相对分子质量不再改变 |
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10 mL 2% H2O2溶液 |
无 |
| ② |
10 mL 5% H2O2溶液 |
无 |
| ③ |
10 mL 5% H2O2溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ |
10 mL 5% H2O2溶液+少量HCl溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ |
10 mL 5% H2O2溶液+少量NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为___________________。
(3)实验①和②的目的是___________________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。
分析上图能够得出的实验结论是_____________________________________________。
(10分)利用催化剂可使NO和CO发生反应:2NO(g)+2C0(g) 2CO2(g)+N2(g) △H<0。
2CO2(g)+N2(g) △H<0。
已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
(1)请填全表中的各空格;
(2)实验I中,NO的物质的量浓度(c)随时问(t)的变化如下图所示。请在给出的坐 标图中画出实验Ⅱ、III中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号。