某研究小组为比较Al和Fe的金属性强弱,设计了图1所示的装置。
(1)甲中锥形瓶内盛放的液体是_______________________。
(2)若要比较产生气体的快慢,可以比较相同时间内产生气体的体积,也可以比较_ 。
(3)为了确保“Al和Fe的金属活动性不同是导致产生气体速率不同的唯一原因”,实验时需要控制好反应条件。实验时除需保证甲中液体的体积、物质的量浓度和温度相同外,还需保证___________。
(4)某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液.回答下列问题:
(注:盐桥常出现在原电池中,是由琼脂和和K2SO4溶液构成的,用来在两种溶液中转移电子。)
(i)发生氧化反应的烧杯是_______ (填“甲”或“乙”).
(ii)外电路的电流方向为:从______到____.(填“a”或“b”)
(iii)电池工作时,盐桥中的SO移向______(填“甲”或“乙”)烧杯.
(iv)甲烧杯中发生的电极反应式为_________.
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 |
金属 质量/g |
金属状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, ,反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 ;
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
。
草酸与高锰酸钾在酸性条件下能够发生反应,现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 |
10%硫酸体积/mL |
温度/℃ |
其他物质 |
| I |
2 mL |
20 |
|
| II |
2 mL |
20 |
10滴饱和MnSO4溶液 |
| III |
2 mL |
30 |
|
| IV |
1 mL |
20 |
1 mL蒸馏水 |
(1)该反应的离子方程式为 。
(2)该反应中氧化剂和还原剂的物质的量之比为 。
(3)如果研究催化剂对化学反应速率的影响,使用实验I和Ⅱ;如果研究温度对化学反应速率的影响,使用实验 (用I~IV表示)。
对比实验I和IV,可以研究 对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 。
为比较Fe3+和Cu2+对H2O2分解的催化效果,甲乙两组同学分别设计了如图一、图二所示的实验。
(1)可通过观察图一的现象: ,而定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进? 。
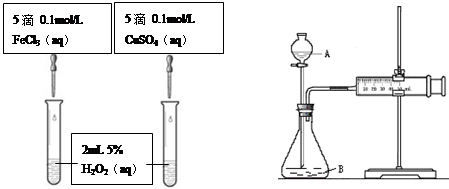
图一 图二
(2)检查图二装置气密性的方法是 。图二所示实验中需测量的数据是 。
控制变量法是研究化学变化量的重要思想方法。请仔细观察下表中50mL
稀盐酸和1g碳酸钙反应的实验数据:
| 实验 序号 |
碳酸钙 状态 |
C(HCl)/ mol·l-1 |
溶液温度/℃ |
碳酸钙消失 时间/s |
|
| 反应前 |
反应后 |
||||
| 1 |
块状 |
0.5 |
20 |
39 |
400 |
| 2 |
粉末 |
0.5 |
20 |
40 |
60 |
| 3 |
块状 |
0.6 |
20 |
41 |
280 |
| 4 |
粉末 |
0.8 |
20 |
40 |
30 |
| 5 |
块状 |
1.0 |
20 |
40 |
120 |
| 6 |
块状 |
1.0 |
30 |
50 |
40 |
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)实验5、6表明 对反应速率的影响。
(3)从本实验数据中分析,影响化学反应速率的因素还有 ,能表明这
一规律的实验序号是 。
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂:1.00 mol·L-1 HNO3、2.00 mol·L-1 HNO3,细颗粒大理石、粗颗粒大理石,35 ℃水浴。
(1)他们能完成哪些因素对速率影响的探究?
____________________________________________________________。
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
(3)整个实验中应控制的不变量是硝酸溶液体积和 。
(4)该实验小组用如图实验装置进行实验。
①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有 。
②干燥管中应放置的试剂是 。
| A.碱石灰 | B.无水CaCl2 |
| C.P2O5固体 | D.浓硫酸 |
③若撤除干燥管装置,所测速率 (填“偏大”、“偏小”或“不变”)。
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 |
金属质 量/g |
金属 状态 |
c(H2SO4)/ (mol·L-1) |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失 的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉 末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉 末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,完成下列问题:
(1)实验4和5表明________________对反应速率有影响,________反应速率越快,能表明同一规律的实验还有________。(填实验序号)
(2)仅表明反应物浓度对反应速率产生影响的实验有________。(填实验序号)
(3)本实验中影响反应速率的其他因素还有________,其实验序号是________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
_____________________________________________
I、某学生实验小组用50mL0.50mol•L—1的盐酸与50mL0.50mol•L—1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定
(1)图中装置缺少的一种仪器,该仪器名称为 。

(2)将反应混合液的 温度记为反应的终止温度。
(3)下列说法正确的是
| A.小烧杯内残留有水,会使测得的反应热数值偏小 |
| B.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验 |
| C.烧杯间填满碎纸条的作用是固定小烧杯 |
| D.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅 |
II、某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。

分析上图能够得出的实验结论是_______________________。
某探究小组用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速度的因素。
实验药品:2.0 mol/L盐酸、4.0 mol/L盐酸、2.0 mol/L硫酸、4.0 mol/L硫酸、相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0 mL,金属用量均为9.0 g。
Ⅰ.甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程 (分钟) |
1 |
2 |
5 |
15 |
20 |
| 4.0 mol/L 盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
| 2.0 mol/L 硫酸 |
无明显现象 |
极少量 气泡 |
少量气泡 |
||
| 4.0 mol/L 硫酸 |
无明显现象 |
少量气泡 |
有比较连续的气泡 |
请回答下列问题:
(1)写出铝与盐酸反应的离子方程式: 。
(2)反应在1~15min内,铝与盐酸的反应速率逐渐增大,其原因是 。
(3)根据以上探究“铝与稀盐酸和稀硫酸的反应速率存在差异的原因”,你能对原因作出哪些假设或猜想: (写出一种即可)。
Ⅱ.乙同学设计了如下影响反应速率因素的实验。请你根据实验目的帮助该同学完成以下实验设计表:
| 实验目的 |
实验 编号 |
温度 /℃ |
金属铝的 形态 |
盐酸浓度 /mol·L-1 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响; 2.实验①和③探究温度对该反应速率的影响; 3.实验①和④探究金属规格(铝片、 铝粉)对该反应速率的影响 |
① |
25 |
铝片 |
4.0 |
| ② |
|
|
|
|
| ③ |
|
|
|
|
| ④ |
|
|
|
下面是某研究小组研究的关于不同催化剂对H2O2分解反应的催化效率。
| 催化剂(0.1g) |
活性炭 |
FeCl3 |
KI |
MnO2颗粒状 |
MnO2粉末状 |
| 前15s产生氧气的量(ml) |
5 |
11 |
7 |
8 |
11 |
| 前30s产生氧气的量(ml) |
8 |
16 |
11 |
11 |
21 |
| 前45s产生氧气的量(ml) |
11 |
20 |
15 |
18 |
35 |
| 前60s产生氧气的量(ml) |
15 |
24 |
20 |
26 |
49 |
(1)写出H2O2在催化剂作用下分解反应的化学方程式________________________
(2)从上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是_____________________,
等质量的固体催化剂,颗粒大小对催化效率有什么影响______________________
(3)实验发现新鲜的动物肝脏对H2O2的分解也有显著的催化作用,但当往溶液中加入
盐酸,或给溶液加热时,就会失去催化能力,合理的解释是
(4)对于FeCl3的催化作用,有人认为是Fe3+起催化作用,有人认为是Cl-,请你设计一
个实验进行验证。_______________________________________________________
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有:__________、__________等。
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为________、________等。
(3)此反应以浓硫酸为催化剂,可能会造成__________、__________等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 |
|
同一反应温度 |
||||
| 反应温度/℃ |
转化率(%) |
选择性(%)* |
|
反应时间/h |
转化率(%) |
选择性(%)* |
| 40 |
77.8 |
100 |
|
2 |
80.2 |
100 |
| 60 |
92.3 |
100 |
|
3 |
87.8 |
100 |
| 80 |
92.6 |
100 |
|
4 |
92.3 |
100 |
| 120 |
94.5 |
98.7 |
|
6 |
93.0 |
100 |
①根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h
C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为________。
碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-═2SO42-+I2(慢),I2+2S2O32-═S4O62-+2I- (快),
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变成为 色。为确保能观察到该现象,S2O32—与S2O82—初始的物质的量需满足的范围为:n(S2O32—):n(S2O82—) 。
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中Vx= mL,反应速率最快的是 (填序号)。
(3)已知图中A曲线为某条件下,浓度c(S2O82—)~ 反应时间t的变化曲线图,若保持
其他条件不变, (填“B”或“C”)曲线为降低反应温度, (填“B”或“C”)曲线为加入催化剂。
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:
| 编号 |
操作 |
实验现象 |
| ① |
分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol·L-1 FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 |
试管A中无明显气泡产生; 试管B中产生的气泡量增加 |
| ② |
另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 |
试管A、B中均未明显见到有气泡产生 |
请回答下列问题:
(1)过氧化氢分解的化学方程式为 。
(2)实验①的目的是___________________________________________________;实验中滴加FeCl3溶液的目的是________________________________________。
(3)实验②未观察到预期的实验现象。为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_________________________(用实验中所提供的试剂或条件)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,分析判断OE、EF、FG三段中,___________段化学反应速率最快。
某研究性学习小组成员,利用稀硫酸与某金属的反应来探究影响化学反应速率的因素,下表是研究过程中记录的实验数据(表中某些数据记录已模糊不清,个别数据已丢失)。若实验操作、数据记录均是正确的,试分析上述数据回答下列问题:
(1)该实验主要是探究___________ 、 和 对反应速率的影响。
(2)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理。