等物质的量A、B、C、D四种物质混合,发生如下反应:
aA(?)+bB(?) cC(固)+dD(?)
cC(固)+dD(?)
当反应进行到一定时间后,测得A减少n mol,B减少 ,C增加
,C增加 ,
,
D增加n mol,此时达到化学平衡状态.
(1)该化学方程式中各系数为a=________,b=________,c=________,d=________.
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,则该反应中各物质的聚集状态是:A_________,B_________,D_________.
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应是________反应(填“放热”或“吸热”
(1)把镁条投入盛有盐酸的敞口容器中,产生氢气速率变化如图所示。
在反应过程中导致速率变化的因素有
①H+的浓度②镁条的表面积③溶液的温度④Cl—的浓度
(2)影响速率的有关因素有:物质本身的性质、浓度、温度、催化剂等方面,依据影响速率的有关因素分析下列问题:
①Mg和Fe均可以与O2反应, Mg在空气中可以点燃, Fe在空气中不能点燃,是由于 的影响;
②Fe在空气中加热不能燃烧,但在纯氧中可以,是由于 的影响;
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率VA=__________,VB=_____________,VC=___________。该反应的化学反应方程式为___________________________。
在2SO2+O2 2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则
2SO3的反应里,开始SO2和O2的浓度均为0.5mol/L,2分钟后测得SO2的浓度为0.25mol/L,则 =_____________________,各物质所表示的反应速率的最简整数比
=_____________________,各物质所表示的反应速率的最简整数比 :
: :
: =_________
=_________
化学反应速率用 时间内 或 的 的变化来表示。在容积不变的反应器中,通常是用 时间内反应物浓度的 或生成物浓度的 来表示,即表达式 ,化学反应速率常用的单位有 。
(6分)对于反应2SO2+O2 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
升高温度 |
|
| ② |
降低温度 |
|
| ③ |
增大氧气的浓度 |
|
| ④ |
使用催化剂 |
|
| ⑤ |
压缩体积 |
|
| ⑥ |
恒容下充入Ne |
|
在50mLH2O2水溶液中加入2g二氧化锰,在标准状况下放出气体的体积与时间的关系如右图所示
(1)该反应的化学方程式为 。
(2)若溶液的体积保持50mL不变,则在前五分钟H2O2的平均反应速率为 mol/(L·min)。
(3)试解释A、B、C各点所表示的反应速率变化的原因
(6分)下图表示Zn投入一定浓度一定体积的稀H2SO4溶液中后,反应时间与生成H2的体积的图象。(纵坐标为H2的生成速率)
(1)反应前期速率加快的原因是: 。
(2)反应后期速率下降的原因是: 。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是: 。
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 |
Ⅰ.可逆反应:A(g)+3B(g) 2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
(1)这时B的浓度为________mol/L,C的浓度为________mol/L。
(2)这段时间内反应的平均速率若以D的浓度变化来表示,应为________mol/(L·min)。
(3)如果保持容器内温度不变,反应前和反应后容器内压强之比为_____(最简整数比)。
Ⅱ.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。请回答以下问题: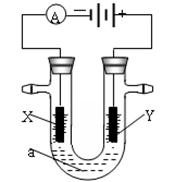
(4)在X极附近观察到的实验现象是:放出气体且______________。检验Y电极反应产物的方法是:把__________________放在Y电极附近,试纸变蓝色。
(5)当通过电解池通过1 mol电子时,两极共收集到________L气体(标准状况),电解池内的液体稀释到500 mL时,NaOH溶液浓度为________mol/L。
在2 L的密闭容器中,充入2 molN2和3 molH2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为 mol/(L·s)。
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B)="0.200" mol/L及c(C)="0" mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B)="0.200" mol/L及c(C)="0" mol/L。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件是:②_______________;③_______________。
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________。
(3)该反应的正反应是 (填“放热”或“吸热”)反应。
(4)实验③前10.0 min内平均反应速度率vB=__________________。
一定量的盐酸和过量的锌粒反应产生氢气,为了减慢反应速率,又不影响产生的氢气的总量,下列措施可行的是 ①加入NaOH固体②加入一定量的水③加入少量硫酸钠溶液④加入少量硫酸铜溶液⑤加入CH3COONa固体⑥加入KNO3溶液。
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为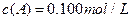 、
、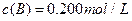 及
及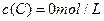 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_______________;
③_______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的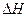 _________0,判断其理由是__________________________________;
_________0,判断其理由是__________________________________;
(4)该反应进行到4.0min时的平均反应速度率:
实验②: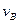 =__________________________________;
=__________________________________;
实验③: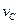 =__________________________________。
=__________________________________。
20℃时,将10mL 0.1 mol/L  溶液和10mL 0.1mol/L的硫酸溶液混合,2 min后溶液明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那末50℃时,同样的反应要看到浑浊,需要的时间是___________s。
溶液和10mL 0.1mol/L的硫酸溶液混合,2 min后溶液明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那末50℃时,同样的反应要看到浑浊,需要的时间是___________s。