(6分)对于反应2SO2+O2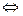 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
升高温度 |
|
| ② |
降低温度 |
|
| ③ |
增大氧气的浓度 |
|
| ④ |
使用催化剂 |
|
| ⑤ |
压缩体积 |
|
| ⑥ |
恒容下充入Ne |
|
(6分)对于反应2SO2+O2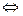 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
升高温度 |
|
| ② |
降低温度 |
|
| ③ |
增大氧气的浓度 |
|
| ④ |
使用催化剂 |
|
| ⑤ |
压缩体积 |
|
| ⑥ |
恒容下充入Ne |
|