以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g)  CO(g)+H2(g) ΔH=" +131.3" kJ•mol-1,
CO(g)+H2(g) ΔH=" +131.3" kJ•mol-1,
①该反应在常温下 自发进行(填“能 ”与“不能”);
”与“不能”);
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 mol H—O键
c .c(CO)=c(H2) d.密闭容器的容积不再改变
.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组] |
温度/℃[来] |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v (CO2) 表示的反应速率为 (取小数二位,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是 (用含a、b的数学式表示)。
草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H2C2O4 + H+ — Mn2++ CO2↑+ H2O(未配平)
现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 |
10%硫酸体积/mL |
温度/℃ |
其他物质 |
| I |
2 mL |
20 |
|
| II |
2 mL |
20 |
10滴饱和MnSO4溶液 |
| III |
2 mL |
30 |
|
| IV |
1 mL |
20 |
1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为 。
(2)如果研究催化剂对化学反应速率的影响,使用实验 和 (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(3)对比实验I和IV,可以研究 对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 。
一定量的锌粉和2mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2总量的是
①石墨②CuO ③铜粉④铁粉⑤浓盐酸⑥无水乙酸
| A.①③④ | B.①③⑤ | C.②④⑥ | D.②⑤⑥ |
反应4A(g )+3B(g) ==2C(g)+D(g),经2min,B的浓度减少0.6 mol•L-1。对此反应速率的表示,正确的是
①用A表示的反应速率是0.4 mol•L-1•min-1
②分别用B、C、D表示的反应速率其比值为3:2:1
③在2 min末的反应速率,用B表示是0.3 mol•L-1•min-1
④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的
A. ①② B. ③ C. ① D. ②④
⑴课本设计了如图一所示实验,其目的是通过比较H2O2的分解速率来比较 ,可通过观察 来定性比 较。有同学提出将CuSO4改为CuCl2更为合理,其理由是 。
较。有同学提出将CuSO4改为CuCl2更为合理,其理由是 。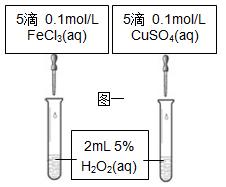
⑵已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____ 的影响。②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是_____
| A.硫酸钾 | B.硫酸锰 | C.水 | D.氯化锰 |
下列4组等质量的铁与过量的盐酸在不同条件下反应,反应速率由快到慢的顺序排列正确的是
| 组别 |
c(HCl)(mol/L) |
温度(℃) |
状态 |
||||
| 1 |
2.0 |
25 |
块状 |
||||
| 2 |
2.5 |
30 |
块状 |
||||
| 3 |
2.5 |
50 |
粉末状 |
||||
| 4 |
2.5 |
30 |
粉末状
|
在2A(g)+B(g)  3C(g)+4D(g)中,下列情况能够降低该反应速率的是
3C(g)+4D(g)中,下列情况能够降低该反应速率的是
| A.升高温度 | B.减小压强 | C.使用催化剂 | D.增大A的浓度 |
下列关于化学反应速率的说法中,不正确的是
| A.化学反应速率是衡量化学反应进行快慢程度的物理量 |
| B.化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 |
| C.在同一个反应中,各物质的反应速率之比等于化学方程式中各物质的化学计量数比 |
| D.化学反应速率的常用单位有mol·L-1·s-1和mol/(L·min) |
下列措施中,能减慢化学反应速率的是
| A.用MnO2作H2O2分解反应的催化剂 |
| B.把石灰石固体研细后与盐酸反应 |
| C.把盛有Cu和稀硝酸的试管浸泡在热水中 |
| D.用10%的H2SO4溶液代替30%的H2SO4溶液与锌粒反应 |
下列措施是为了降低化学反应速率的是
| A.食品放在冰箱中贮藏 |
| B.用铁粉代替铁钉与稀硫酸反应制取氢气 |
| C.合成氨工业中使用催化剂 |
| D.在试管中进行铝和盐酸反应时,稍微加热 |
甲醇被称为21世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。①CH4(g)+H2O (g) CO(g)+3H2(g) △H1 ②CO(g)+2H2(g)
CO(g)+3H2(g) △H1 ②CO(g)+2H2(g) CH3OH(g)△H2 将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示:
CH3OH(g)△H2 将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示:
(1)温度不变,缩小体积,增大压强,①的反应速率 (填“增大”.“减小”.“不变”),平衡向 方向移动。
(2)反应①的△H1 0,(填“﹤”“﹦”“﹥”),其平衡常数表达 式为K= ,100℃,压强为p1时平衡常数的值是 。
式为K= ,100℃,压强为p1时平衡常数的值是 。
(3)在压强为0.1Mpa条件下,将a mol CO与3a molH2的混合气体在催化剂作用下进行反应②。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下空格中填入剩余的实验条件数据。
| 实验编号 |
T℃ |
n(CO)/n(H2) |
p (Mpa) |
| I |
150 |
1/3 |
0.1 |
| Ⅱ |
|
|
5 |
| Ⅲ |
350 |
|
5 |
(4)近几年开发的甲醇燃料电池是采用铂电极,电池中的质子交换膜只允许质子和水分子通过,其工作原理示意图如下:
请回答
①Pt(a)电极的电极反应式为
②如果该电池工作时电路中通过2mol电子则消耗的CH3OH有 mol。
在密闭容器中进行反应2SO2 (g) + O2 (g)  2SO3 (g) ,△H < 0 。如图4是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的原因可能是( )
2SO3 (g) ,△H < 0 。如图4是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的原因可能是( )
| A.催化剂失效 |
| B.减小了生成物的浓度 |
| C.降低了体系的温度 |
| D.增大了容器的体积 |
在80℃时,将0.40 mol的N2O4气体充入1 L固定容积的密闭容器中发生反应:N2O4  2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4)(mol) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2)(mol) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)在20s — 40s之间,用N2O4表示的平均反应速率为 。
(2)在80℃时该反应的平衡常数K= 。
(3)要增大该反应的平衡常数,可采取的措施有(填序号) 。
①增大N2O4的起始浓度 ②向混合气体中通入NO2
③使用高效催化剂 ④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)反应进行至100s后若向容器中再充入0.40 mol的N2O4气体,则达到新平 衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。
衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。
(8分)在某温度时,把 0.5mol N2O4 气体通入体积为5L的密闭容器中,2s时NO2的浓度为0.02mol.L-1,60s时达到平衡,此时容器内的压强为开始时的1.6倍。试回答下列各问题:
(1)2s时用N2O4浓度变化表示的化学反应速率是_________________。
(2)2s时,体系内的压强为开始时的 ________倍,此时N2O4的分解率为_______。
( 3)达到平衡时,平衡混合物中N2O4的物质的量为____________,
3)达到平衡时,平衡混合物中N2O4的物质的量为____________,
下列措施是为了降低化学反应速率的是
| A.食品放在冰箱中贮藏 | B.工业炼钢用纯氧代替空气 |
C.合成氨工业中使用催化剂 | D.在加热条件下,用氢气还原氧化铜 |