下列叙述中,正确的是
| A.熵变大于0的反应肯定是自发的 |
| B.焓变小于0的反应肯定是自发的 |
| C.对于同一物质在不同状态时的熵值是:气态>液态>固态 |
| D.自发反应的反应速率肯定很快 |
已知反应X(g)+Y(g)  nZ(g) ΔH <0,将X和Y以一定比例混合通入2L密闭容器中进行反应,各物质的物质的量随时间的改变如图。下列说法正确的是( )
nZ(g) ΔH <0,将X和Y以一定比例混合通入2L密闭容器中进行反应,各物质的物质的量随时间的改变如图。下列说法正确的是( )
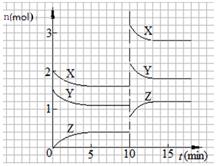
| A.反应方程式中n=2 |
| B.该反应的ΔS>0 |
| C.10 min时,曲线发生变化的原因是增大压强 |
| D.0~5min内,平均反应速率v(X)=0.04 mol·L-1·min-1 |
在2A+B 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是
| A.反应进行的方向 | B.反应的快慢 |
| C.反应进行的限度 | D.反应物的多少 |
在2升的密闭容器中,发生以下反应:2A(g)+B(g) 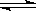 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
| A.1.6 mol | B.2.8 mol | C.2.4 mol | D.1.2 mol |
设C+CO2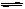 2CO,
2CO,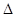 H1>0反应速率为υ1; N2+3H2
H1>0反应速率为υ1; N2+3H2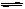 2NH3,
2NH3,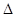 H2<0反应速率为υ2。对于上述反应,当温度升高时,υ1和υ2的变化情况为:
H2<0反应速率为υ2。对于上述反应,当温度升高时,υ1和υ2的变化情况为:
| A.同时增大 | B.同时减小 | C.υ1增大,υ2减小 | D.υ1减小,υ2增大 |
有关下列图像的说法正确的是
| A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 |
| B.根据图②判断,物质A反应生成物质C的△H>0 |
| C.曲线图③可表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化 |
| D.开关K置于A或B处均可减缓铁的腐蚀 |
T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g) Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s |
0 |
2 |
4 |
6 |
8 |
| n(Cl2) / mol |
0 |
0.16 |
0.19 |
0. 20 |
0.20 |
下列说法正确的是
A.反应在前2 s 的平均速率v(CO)= 0.080mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(Cl2)=" 0.11" mol·L-1,则反应的ΔH<0
C.T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆
D.T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80%
下列图示与对应的叙述相符的是 ( )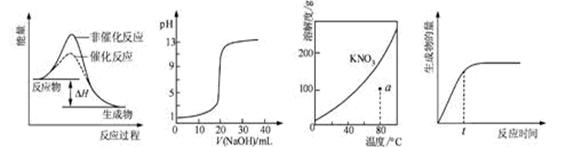
图1 图2 图3 图4
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正 > v逆 |
(双选)在1 L密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
 浓度 浓度时间 |
c(NH3) (mol/L) |
c(O2 ) (mol/L) |
c(NO) (mol/L) |
| 起始 |
0.8 |
1.6 |
0 |
| 第2min |
0.6 |
a |
0.2 |
| 第4min |
0.3 |
0.975 |
0.5 |
| 第6min |
0.3 |
0.975 |
0.5 |
| 第8min |
0.7 |
1.475 |
0.1 |
| 第10min |
0.7 |
1.475 |
0.1 |
下列说法错误的是
A.反应在第2 min到第4min时,O2的平均反应速率为0.1875 mol/(L·min)
B.反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4 min时、第8 min时分别达到化学平衡,且平衡常数不相同
D.在开始反应的前2 min内,该反应的△H=-0.05Q kJ·mol-1
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应: SO2(g)+NO2(g) SO3(g)+NO(g) 达到平衡,正反应速率随时间变化如图所示。则正确的结论是
SO3(g)+NO(g) 达到平衡,正反应速率随时间变化如图所示。则正确的结论是
| A.逆反应速率:a点小于点c |
| B.反应物浓度:a点小于点b |
| C.反应在c点时SO2的转化率最大 |
| D.反应物的总能量低于生成物的总能量 |
增大压强对下列反应的速率无影响的是 ( )
| A.CO2(g) + Ca(OH)2 = CaCO3↓ + H2O |
B.H2 + I2 2HI 2HI |
| C.NaCl +AgNO3 = AgCl↓ + NaNO3 |
D.N2 +3H2 2NH3 2NH3 |
下列说法正确的是
| A.一定条件下,增加反应物的量,必定加快反应速率 |
| B.升高温度正反应速率增大,则逆反应速率也一定增大 |
| C.可逆反应的特征是正反应速率总是和逆反应速率相等 |
| D.使用催化剂一定会加快反应速率 |
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是
| A.10℃ 20mL 3mol/L的盐酸溶液 | B.20℃ 30mL 2mol/L的盐酸溶液 |
| C.20℃ 20mL 2mol/L的盐酸溶液 | D.20℃ 10mL 4mol/L的盐酸溶液 |