同温同压下,等质量的O2和O3相比较,下列结论正确的是
| A.它们的分子数目之比是1:1 | B.它们的氧原子数目之比为2:3 |
| C.它们的密度之比为2:3 | D.它们的体积之比是1:1 |
与100mL 0.5mol·L—1NaCl溶液中的Cl-的物质的量浓度相同的是
| A.100mL 0.5 mol·L—1MgCl2溶液 | B.100mL 0.5mol·L—1KClO3溶液 |
| C.200mL 0.25 mo l·L—1 KCl溶液 | D.200mL 0.5mol·L—1 HCl溶液 |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B.25oC,1.01×105Pa,64gSO2中含有的原子数为3NA |
| C.在常温常压下,11.2LCl2含有的分子数为0.5NA |
| D.标准状况下,11.2LH2O含有的分子数为0.5NA |
下列叙述正确的是
| A.同温同压下,相同体积的物质,它们的物质的量必相等 |
| B.任何条件下,等物质的量的N2和CO所含的分子数必相等 |
| C.1L一氧化碳气体一定比1L氧气的质量小 |
| D.铁的摩尔质量在数值上等于铁原子的相对原子质量 |
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在agHmX中所含质子的物质的量是
A. (A-N+m)mol (A-N+m)mol |
B. (A-N)mol (A-N)mol |
C. (A-N)mol (A-N)mol |
D. (A-N+m)mol (A-N+m)mol |
设NA为阿伏伽德罗常数的值.下列说法正确的是
| A.1mol乙烯分子中含有的共价键数目为4NA |
| B.2L 0.5mol•L﹣1(NH4) 2SO4溶液中NH4+离子总数为2NA |
| C.1mol FeBr2与足量氯气反应时,转移的电子数为3NA |
| D.1mol Na2O2固体中含离子总数为4NA |
实验室需480 mL 1.0 mol/L的NaOH溶液,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是
| A.称取氢氧化钠20.0 g |
| B.定容时俯视观察刻度线 |
| C.移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗 |
| D.移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方 |
将4体积的H2和1体积的O2混合,4 g这种混合气体在标准状况下所占的体积是
| A.5.6 L | B.11.2 L | C.22.4 L | D.33.6 L |
NA表示阿伏加德罗常数。则下列叙述中,正确的是
| A.32g S2-中电子数目为2NA |
| B.46 gNO2和N2O4的混合物中含有的原子数为3NA |
| C.1 L 0.5 mol•L-1 Na2CO3溶液中含有的CO32-数为0.5NA |
| D.78 g Na2O2中阴离子数目为2NA |
A气体的摩尔质量是B气体的n倍,同温同压下,B气体的质量是同体积空气的m倍,则A的相对分子质量为
| A.m/n | B.29m/n | C.29mn | D.29n/m |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B.25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA |
| C.在常温常压下,11.2 L Cl2含有的分子数为0.5NA |
| D.标准状况下,11.2 L H2O含有的分子数为0.5NA |
配制一定物质的量浓度的某溶液,下列情况会使配制结果偏低的是
| A.未冷却即转移、定容 | B.未洗烧杯及玻璃棒 |
| C.定容时俯视刻度线观察液面 | D.容量瓶中原有少量蒸馏水 |
将4gNaOH固体溶于水配成50mL溶液,取出其中5mL,则这5mLNaOH溶液的物质的量浓度为
| A.2mol/L | B.1mol/L | C.0.1mol/L | D.0.05mol/L |
下列叙述正确的是
| A.标准状况下任何气体的摩尔体积都是22.4 L |
| B.1 mol气体的体积若是22.4 L,它必定处于标准状况 |
| C.两种气体的物质的量之比等于其原子个数比 |
| D.标准状况下,1 mol H2和O2的混合气体的体积是22.4 L |
某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为
A.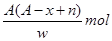 |
B. |
C.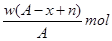 |
D. |