下列溶液中,和100mL 0.5mol/L NaCl溶液所含的Cl— 物质的量浓度相同的是( )
| A.100mL 0.5mol/L MgCl2溶液 |
| B.200mL 0.25mol/L AlCl3 |
| C.50ml 1mol/L NaCl溶液 |
| D.25ml 0.5mol/L HCl溶液 |
下列说法正确的是( )
| A.摩尔是物质的质量的单位 | B.氢气的摩尔质量是2g |
| C.1mo1OH-的质量是17 g | D.1mol气体所占的体积一定是22·4L |
设NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.1mol金刚石中含有C-C键数目为4NA |
| B.56g铁粉在1mol Cl2中充分反应失去电子数为2NA |
| C.1L 0.1mol·L-1氨水中所含的离子和分子总数为0.1NA |
| D.标准状况下,44.8L NO2与N2O4混合气体中分子总数小于2NA |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温下,1.0 L 1.0 mol.L-1 KAlO2溶液中含有的氧原子数为2NA |
| B.7.8gNa2O2固体中含有的阴离子数为0.2NA |
| C.标准状况下,体积为2.24 L的CO2和SO2的混合气体中含有的氧原子数为0.2 NA |
| D.0.l mol Cl2参加氧化还原反应,转移的电子数目一定是0.2NA |
单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点越高。下列溶液中沸点最高的是
| A.0.01 mol/L的蔗糖溶液 | B.0.01 mol/L的K2SO4溶液 |
| C.0.02 mol/L的NaCl溶液 | D.0.02 mol/L的CH3COOH溶液 |
下列叙述正确的是
| A.Na在足量O2中燃烧,消耗lmol O2时转移的电子数是4×6.02×1023 |
| B.盐酸和醋酸的混合溶液pH=1,该溶液中c(H+) =" 0.1" mol/L |
C.1 L 0.1 mol/L NH4Cl溶液中的NH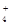 数是0.1×6.02×1023 数是0.1×6.02×1023 |
| D.标准状况下2.24 L Cl2中含有0.2 mol 共价键 |
设NA为阿伏加德罗常数的值,下列说法不正确的是
| A.80gCuO和Cu2S的混合物含有的Cu原子数一定是NA |
| B.标准状况下, 5.6L O2作为氧化剂时转移的电子数一定为NA |
| C.常温常压下,14g C2H4和C3H6混合气体中含有的原子数为3NA |
| D.25℃,1LpH=13的NaOH溶液中含有OH﹣的数目为 0.1NA |
下列说法正确的是( )
| A.1mol任何物质的体积都约是22.4L |
| B.1molH2所占的体积约是22.4L |
| C.1molH2和1mol H2O所含的分子数相同 |
| D.16gN2和16gO2所含的分子数相同 |
下列叙述正确的是( )
| A.常温常压下,1.5 mol N2的体积约为33.6 L |
| B.NaOH的摩尔质量是40 g |
| C.150mL 1 mol/LNaCl溶液与100mL 1 mol/LAlCl3溶液中的n(Cl-)相等 |
| D.同温同压下,相同体积的C12和SO2气体所含的分子数一定相同 |
下列说法中正确的是
| A.1mol O的质量是16g·mol-1 | B.Na+的摩尔质量是23 g·mol-1 |
| C.1mol CO2的质量是44 g·mol-1 | D.氢的摩尔质量是2 g·mol-1 |
在国际单位制中,物质的量的基本单位是
| A.千克 | B.摩尔 | C.克/摩尔 | D.摩尔/升 |
常温常压下,乙烷、乙炔和丙烯组成的混合烃64mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了112 mL,原混合烃中乙炔的体积分数为
| A.12.5% | B.25% | C.50% | D.75% |
下列对实验操作分析错误的是
| A.配制0.1mol/LNaCl溶液时,若没有洗涤烧杯和玻璃棒,则所得溶液物质的量浓度偏低 |
| B.NH4NO3溶解吸热,若配制0.5mol/L NH4NO3溶液时直接将溶解后的溶液转移到容量瓶中,则所得溶液的物质的量浓度偏高 |
| C.配制一定物质的量浓度溶液时,若所用砝码已经生锈,则所得溶液的物质的量浓度偏高 |
| D.配制一定物质的量浓度溶液时,若定容中不小心加水超过刻度线,立刻将超出的水吸出,则所得溶液的物质的量浓度偏低 |