向一定量的NaOH固体中加入由硫酸铜和硫酸组成的混合物的溶液,充分搅拌,恰好完全反应,有蓝色沉淀生成,过滤,所得滤液的质量与加入的原混合物溶液的质量相等。则与硫酸铜反应的氢氧化钠和与硫酸反应的的氢氧化钠的物质的量之比为?
将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如右图所示。

当V1=140 mL时,则金属粉末中:n(Mg) =________ mol,V2=______ ml。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a ,用100 mL 2 mol·L-1的H2SO4 ,再加入480 mL 1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是_________。
Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体 g。
(1)在该溶液的配制过程中,用到的玻璃仪器: 、胶头滴管、量筒、烧杯、玻璃棒。
(2)如果在定容时仰视,溶液浓度将 ;若定容时液面高于刻度线应采取的措施是 。
Ⅱ、取上述实验中配制的NaOH溶液100mL,缓慢通入一定量的CO2,充分反应,测得最后溶液呈碱性。
(1)此时溶液的溶质若是单一成分,可能是 或 。
(2)若果在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑溶解于水)关系如图所示。
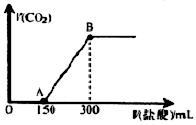
①由图可知,碱性溶液中的单一溶质为 。
②请写出0-A段所发生反应的离子方程式 。
③B点时,产生的CO2在标准状况下的体积为 mL;B点时,反应所得溶液中溶质的物质的量浓度是 mol/L(两种溶液混合时体积可以直接相加)。
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A.标准状况下,5.6 L O2作氧化剂时转移电子数一定为NA |
| B.用惰性电极电解CuSO4溶液后,如果加入0.1 mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA |
| C.已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5 mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA |
| D.142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上常通过以下两步反应制备K2FeO4:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O ②Na2FeO4+2KOH=K2FeO4+2NaOH,下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中NaClO是氧化剂 |
| C.Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 |
| D.若有2molFeCl3发生反应,转移电子的物质的量为6mol |
将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X。
(1)写出碳酸氢钠分解产生的气体分别与过氧化钠反应的化学反应方程式:
_________________、_________________________。
(2)残余固体X的成分是____________。
| A.Na2O2、NaOH | B.Na2O2、Na2CO3 | C.NaOH、Na2CO3 | D.Na2O2、NaOH、Na2CO3 |
(3)向固体X中逐滴加入1mol/L的稀盐酸至不再产生气泡为止,产生的气体在标准状况下的体积为____L。请以V(HCl)为横坐标,V(CO2)为纵坐标,画出产生CO2的体积和加入稀盐酸溶液体积的关系。
已知:MnO2+4HCl MnCl2+Cl2↑+2H2O,一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(所设反应前后体积不变),请计算:
MnCl2+Cl2↑+2H2O,一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(所设反应前后体积不变),请计算:
(1)反应耗用MnO2的质量;(2)被氧化的HCl物质的量;(3)跟浓盐酸的物质的量浓度。
设NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
| B.一定温度下,1 L 0.50 mol·L-1 NH4NO3溶液中含氮原子个数为NA |
| C.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA |
D.235g核素 U发生裂变反应: U发生裂变反应: U+ U+ n n  Sr+ Sr+ Xe+10 Xe+10 n,净产生的中子( n,净产生的中子( n)数为10NA n)数为10NA |
某同学按下述操作配制100 mL 0.20 mol·L-1Na2SO4溶液,请回答有关问题。
| (1)实验步骤 |
有关问题 |
| ①计算所需Na2SO4的质量 |
需要称量Na2SO4的质量为________g |
| ②称量Na2SO4固体 |
称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100 mL烧杯中,并加入适量水 |
用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) |
仪器A是________________; |
| ⑤洗涤烧杯,转移,定容 |
|
| ⑥摇匀、装瓶、贴上标签 |
(2)取出该Na2SO4溶液10 mL加水稀释到100 mL,稀释后溶液中Na+的物质的量浓度是__________。
(3)在实验中,以下操作对实验结果没有影响的是__________。
A.没有将洗涤液转移到容量瓶中
B.定容时仰视刻度线
C.转移前没有将使用的容量瓶烘干
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
(4)请写出检验溶液中的SO42-的具体操作:__________________________。
某同学利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略):
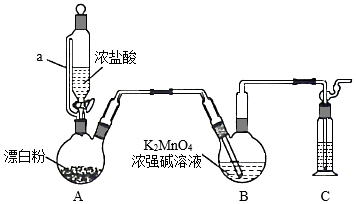
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO42﹣+2H2O═2MnO4﹣+MnO2↓+4OH﹣
回答下列问题:
(1)装置A中a的作用是 ;装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入 酸式 (填“酸式”或“碱式”)滴定管中;在规格为50.00 mL的滴定管中,若KMnO4溶液起始读数为15.00 mL,此时滴定管中KMnO4溶液的实际体积为 (填标号)。
A.15.00 mL B.35.00 mL C.大于35.00 mL D.小于15.00 mL
(4)某FeC2O4•2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4•2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.称取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃.用c mol•L﹣1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2 mL。
样品中所含H2C2O4•2H2O(M=126g•mol﹣1)的质量分数表达式为 。
下列关于样品组成分析的说法,正确的是 (填标号)。
A. 3时,样品中一定不含杂质
B. 越大,样品中H2C2O4•2H2O含量一定越高
C.若步骤Ⅰ中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A.常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA |
| B.标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
| C.92 g NO2和N2O4的混合气体中含有的原子总数为6NA |
| D.100g 17%的氨水,溶液中含有的NH3分子数为NA |
汽车发生强烈碰撞时,安全气囊内的NaN3发生化学反应生成氯化钠(Na3N)与氮气,所产生的气体快速充满气囊,可以达到保护车内人员的目的。
(1)请写出上述反应方程式: ;它的基本反应类型是 。
(2)若安全气囊内含有195gNaN3,其物质的量为 。
(3)若195gNaN3完全分解,在标准状况下,气囊膨胀的体积约为 。
(4)28gKOH固体必须溶解在 g水中,才能使每200个水分子中有1个K+。
(5)Mg能在O2、N2、CO2中燃烧,写出镁在CO2中燃烧的化学方程式 。
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g ·mol-1) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
0.87 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
0.316 |
158 |
| 硝酸银 |
0.075 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)硫酸钾在水中的电离方程式为______________________。
(3)配制1L上述“鲜花保鲜剂”所需的仪器有:量筒、玻璃棒、药匙、烧杯、__________、__________、_________。(在横线上填写所缺仪器的名称),需要高锰酸钾________mol
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为_______ mol/L。
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A.200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA |
| B.1 mol -CH3和1 mol OH- 都含有10 NA个电子 |
| C.标准状况下3.36 L CCl4含碳原子数为0.15NA |
| D.1mol Na完全反应生成Na2O2时失去NA个电子 |