500℃条件下,在恒容密闭容器中,充入1molNO2存在如下平衡2NO2(g) N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的
N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的
| A.容器内气体颜色先变深后变浅,最后比原来还要浅 |
| B.反应向正反应方向移动 |
| C.NO2的转化率变小 |
| D.N2O4的体积分数一定增大 |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是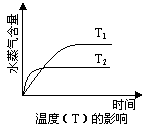
A.CO2(g) + 2NH3(g) CO(NH2)2(s) + H2O(g);△H<0 CO(NH2)2(s) + H2O(g);△H<0 |
B.CO2(g) + H2(g) CO(g) + H2O(g);△H>0 CO(g) + H2O(g);△H>0 |
C.CH3CH2OH (g) CH2=CH2(g) + H2O(g);△H>0 CH2=CH2(g) + H2O(g);△H>0 |
D.2C6H5CH2CH3(g) + O2(g) 2 C6H5CH=CH2(g) + 2H2O(g);△H<0 2 C6H5CH=CH2(g) + 2H2O(g);△H<0 |
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH<0
2 PbCrO4(s)+2H+(aq) ΔH<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是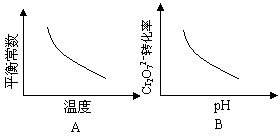
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。可以判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。可以判断该分解反应已经达到化学平衡的是
| A.2v(NH3)= v(CO2) |
| B.密闭容器中气体的总物质的量不变 |
| C.密闭容器中混合气体的密度不变 |
| D.密闭容器中二氧化碳的体积分数不变 |
一定量的混合气体,在密闭容器中发生如下反应:xA(g) + yB(g)  zC(g),达到平衡后测得A气体的浓度为2.5mol/L,当恒温下将密闭容器的容积缩小到原体积1/2时,再达到平衡后,测得A浓度为4.5mol/L,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为2.5mol/L,当恒温下将密闭容器的容积缩小到原体积1/2时,再达到平衡后,测得A浓度为4.5mol/L,则下列叙述正确的是
| A.平衡向逆反应方向移动 |
| B.x + y < z |
| C.C的体积分数提高 |
| D.B的转化率提高 |
密闭容器中,反应2A+B  2C达平衡时,若增大压强,则平衡向生成C的方向移动,则以下关于此反应的叙述中正确的是
2C达平衡时,若增大压强,则平衡向生成C的方向移动,则以下关于此反应的叙述中正确的是
A.A和B中至少有一种是气体
B. C肯定不是气体
C.如果C为气体,A、B一定均为气体
D. A、B、C一定均为气体
下列现象不是由平衡移动引起的是
| A.氯水光照颜色变浅 |
| B.使用排饱和食盐水的方法收集氯气 |
| C.H2、I2、HI平衡混合气加压颜色变深 |
| D.重铬酸钾溶液中加碱颜色变为黄色 |
已知反应mX(g)+nY(g) qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
| A.通入稀有气体使压强增大,平衡将正向移动 |
| B.X的正反应速率是Y的逆反应速率的m/n倍 |
| C.降低温度,混合气体的平均相对分子质量变小 |
| D.增加X的物质的量,Y的转化率降低 |
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )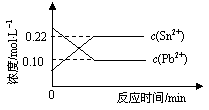
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
下列叙述中不正确的是
| A.某特定反应的平衡常数仅是温度的函数 |
| B.催化剂不能改变平衡常数的大小 |
| C.化学平衡发生新的移动,平衡常数必发生变化 |
| D.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
(选做题)在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是____
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。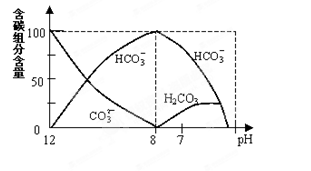
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”) 大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度的大小关系是:
。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh= 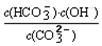 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是
| A.pH=3的硝酸跟pH=11的氢氧化钾溶液 | B.pH=3的盐酸跟pH=11的氨水溶液 |
| C.pH=3的硫酸跟pH=11的氢氧化钠溶液 | D.pH=3的醋酸跟pH=11的氢氧化钡溶液 |
工业制硫酸的反应之一是:
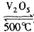
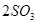 。如果反应在密闭容器中进行,下列说法错误的是
。如果反应在密闭容器中进行,下列说法错误的是
A.当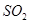 的物质的量不再改变时,该反应达到了平衡状态 的物质的量不再改变时,该反应达到了平衡状态 |
B.达到平衡时,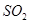 的浓度与 的浓度与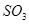 的浓度一定相等 的浓度一定相等 |
C.在给定条件下达平衡时,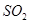 的转化率达到了最大 的转化率达到了最大 |
D.使用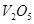 催化剂是为了加快反应速率,提高生产效率 催化剂是为了加快反应速率,提高生产效率 |
某温度下,在甲、乙、丙三个恒容密闭容器中投入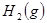 和
和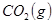 ,发生反应
,发生反应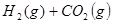
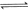
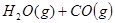 ,其起始浓度如下表所示。测得平衡时甲中
,其起始浓度如下表所示。测得平衡时甲中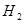 的转化率是60%。下列判断正确的是
的转化率是60%。下列判断正确的是
| 起始浓度 |
甲 |
乙 |
丙 |
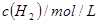 |
0.010 |
0.020 |
0.020 |
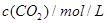 |
0.010 |
0.010 |
0.020 |
A. 甲中达到平衡所需时间最短
B. 平衡时,反应的平衡常数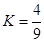
C. 平衡时,丙中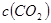 是甲中的2倍
是甲中的2倍
D. 平衡时,乙和丙中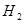 的转化率均是60%
的转化率均是60%