向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g) + bB(g)  pC(g) △H=?反应情况记录如下表:
pC(g) △H=?反应情况记录如下表:
| 时间/(min) |
n(A)/( mol) |
n(B)/( mol) |
n(C)/( mol) |
| 0 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.4 |
| 第4 min |
0.4 |
1.8 |
1.2 |
| 第6 min |
0.4 |
1.8 |
1.2 |
| 第8 min |
0.1 |
2.0 |
1.8 |
| 第9 min |
0.05 |
1.9 |
0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率V(A)= mol•L-1• min-1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8 min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min 或 ;
②第6min ;
③第8 min 。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92kJ则该反应的△H= 。
(4)反应在第4 min建立平衡,此温度下该反应的化学平衡常数K= .
Ⅱ.已知:常温下,A酸的溶液pH=a, B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
A.大于7 B.等于7 C. 小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为
mol•L-1,B溶液中水电离出的氢离子浓度为 mol•L-1。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为:
。
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同
b.2v (Cr2O72—) =v (CrO42—)
c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+ (aq)+3OH—(aq) 常温下,Cr(OH)3的溶度积
Cr3+ (aq)+3OH—(aq) 常温下,Cr(OH)3的溶度积
Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
(每空格3分,计18分)工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为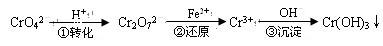
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的阳极反应式为:
。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) 。溶液中同时生成的沉淀还有 。
中学常用淡黄色的pH试纸测定溶液的酸碱性。在25℃时,若溶液的pH=7,试纸不变色;若pH< 7 ,试纸变红色;若pH > 7,试纸变蓝色。
⑴已知水中存在如下平衡: H2O + H2O  H3O+ + OH-。现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是
H3O+ + OH-。现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是
| A.向水中加入NaHSO4 | B.向水中加入Cu(NO3)2 | C.加热至100℃ | D.向水中加入(NH4)2SO4 |
⑵现要用pH试纸测定100℃沸水的pH。若则试纸显 色,溶液呈 性(填酸、碱或中)。
⑶纯碱因水溶液显碱性而得名。请用离子方程式表示显碱性的原因:
。
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知2SO2(g)+ O2(g)  2SO3(g)
2SO3(g)  kJ·mol
kJ·mol )
)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
2mol SO2、1mol O2 |
2mol SO3 |
4mol SO3 |
SO3的浓度(mol· L L ) ) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
 |
 |
 |
(1)根据上表下列说法正确的是
A. B.
B. C.
C. D.
D.
(2)甲容器中的进行反应的平衡常数表达式 。
(3)甲容器平衡时SO2的转化率 (用含有a的代数式表示)
(4)关于2SO2(g)+ O2(g)  2SO3(g)下列说法正确的是
2SO3(g)下列说法正确的是
A.保持容器等温等压状态,待反应平衡后,再加1mol SO3重新平衡,SO3体积分数小于原平衡
B.平衡时,测得 SO2的转化率为12. 5%,O2的转化率为25%, 开始充入容器中的SO2、O2物质的量之比为4∶1
SO2的转化率为12. 5%,O2的转化率为25%, 开始充入容器中的SO2、O2物质的量之比为4∶1
C.反应混合物中,SO3的质量分数不再改变时反应处于平衡
D.保持容器等温等容状态,待反应平衡后,再加1mol SO3重新平衡,SO3体积分数小于原平衡
哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖, 。右图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
。右图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度: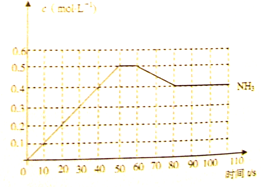
(1)此反应在50~60s时化学平衡常数为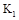 = (列出计算式不用试算)。
= (列出计算式不用试算)。
(2)反应进行到60s时,改变的条件可能是 。
| A.加入催化剂 | B.扩大容器的体积 |
| C.升高温度 | D.减小氨气的浓度 |
在该条件下,氮气的化学反应速率 (填“变小”、“变大”或“不变”)
(3)该反应在80S后化学平衡常数为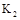 ,则
,则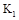
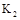 (填“>”,“<”或“=”),此时氮气的转化率为 。
(填“>”,“<”或“=”),此时氮气的转化率为 。
(4)若在110s后向该平衡体系中再加入1mol氨气,则再次达平衡后,氨气在平衡体系中的体积分数 。(填“变小”、“变大”或“不变”)
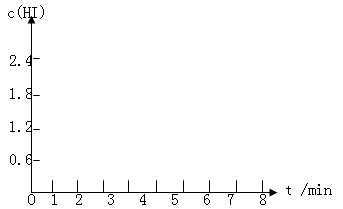
将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)  2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
| HI体积分数 |
1min |
2min |
3min |
4min |
5min |
6min |
7min[ |
| 条件I |
26% |
42% |
52% |
57% |
60% |
60% |
60% |
| 条件II |
20% |
33% |
43% |
52% |
57% |
65% |
65% |
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H__________0(填">","<"或"=")
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:
A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如下图所示。设35min和55min的平衡常数分别为K1、K2。
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如下图所示。设35min和55min的平衡常数分别为K1、K2。

回答下列问题:
(1)反应方程式中的x= ;20min时的平衡常数 K = 。
(2)8min时A的转化率为 。
(3)30min时改变的条件是 。
(4)若40min时改变的条件是升高温度,则K1 K2(填“>”或“<”或“=”, 下同)。
(5)能判断反应A(g)+xB(g) 2C(g),达到化学平衡状态的依据是 (填序号)。
2C(g),达到化学平衡状态的依据是 (填序号)。
A.恒容容器中压强不变 B.混合气体中c(A)不变
C.2v正(A)= v逆(C) D.2c(A)= c(C)
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)。体系中,n(NO)随时间的变化如表:
2NO2(g)。体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知: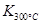 >
>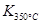 ,则该反应是 热反应。
,则该反应是 热反应。
(2)图中表示NO2的变化的曲线是 。
用O2表示从0~2 s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
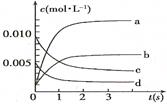
甲醇是一种可再生能源,在日常生活中有着广泛的应用.工业上用CO生产燃料甲醇,如:CO(g)+2H2(g)⇌CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
请回答下列问题:
(1)图1表示使用和未使用催化剂时反应过程和能量的对应关系.下列有关催化剂的说法不正确是
| A.降低分子的能量 | B.增加了活化分子数 |
| C.提高了活化分子百分数 | D.增加了单位体积内的活化分子数 |
(2)从反应开始到建立平衡,该过程中释放 kJ热量.
(3)在T2℃下,将2molCO和6molH2充入2L的密闭容器中,达到平衡状态时,测得c(CO)=0.2mol•L﹣1,则CO的转化率为 .
(4)如图3为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图如.电池总反应为2CH3OH+3O2⇌2CO2+4H2O.在电脑的使用过程中,电池的温度往往因为各种原因会升高.温度升高_____________(填:“有利于”或“不利于”)电池将化学能转化为电能.该装置中___________(填:“a”或“b”)为电池的负极,该电极反应式为 .
氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
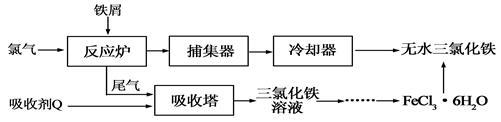
(1)试写出吸收塔中吸收剂Q反应的离子方程式: 。
(2)六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。再由FeCl3·6H2O晶体得到无水FeCl3的操作是: 。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=4×10-38)。
(4)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式 。
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
将固体NH4I置于密闭容器中,某温度下发生下列变化:
NH4I(s)  NH3 (g) + HI(g) 2HI(g)
NH3 (g) + HI(g) 2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
当反应达到平衡时c (H2)=" 0.5" mol/L, c (HI)=" 4" mol/L, 则 c(NH3) ,HI 的
分解率为 。
(10分)痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:①HUr(尿酸,aq) Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6) ②NaUr(s)
Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6) ②NaUr(s)  Ur-(aq)+Na+(aq)
Ur-(aq)+Na+(aq)
(1)37°时,1.0 L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________。
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp________(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是________(填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol·L—1,其中尿酸分子的浓度为5.0×10—4mol·L—1,该病人尿液的c(H+)为 ,PH 7(填“>”、“=”或“<”)。
甲醇是一种非常好的燃料。熔点-97.8°C,沸点64.5°C。一定条件下,
CO与H2反应可制得甲醇:CO+2H2  CH3OH
CH3OH
图1表示该反应进行过程中的能量变化:
图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,结合图1写出液态CH3OH燃烧热的热化学方程式 。
(2)根据上图2计算:该温度下,反应CO(g)+2H(g) CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
A.降低温度 B.加催化剂
C.充入氩气,使体系压强增大 D.再充入1molCO和2molH2
E.恒温恒容改为恒温恒压
(3)已知:CH3OH可以在一定条件下转化为HCOOH,HCOOH和CH3COOH性质相似。25°C,0.1mol/LHCOOH溶液的pH>1。室温下,向0.1mol/L的HCOOH溶液中滴加NaOH溶液,当溶液中离子浓度关系满足:c(HCOO-)<c(Na+)时,则反应的情况可能为 。(填字母)
A.NaOH不足,HCOOH剩余
B.HCOOH与NaOH恰好完全反应
C.NaOH过量