在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间/s 浓度mol·L-1 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4)mol·L-1 |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2)/mol·L-1 |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)达到平衡时N2O4的转化率为 %,表中c2 c3,a b (选填“>”“<”“=”)。
(2)20s的四氧化二氮的浓度c1= mol·L-1,在0s~20s内四氧化二氮的平均反应速率为 mol·(L·s)-1;。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是 mol·L-1。
把4 mol N2和8 mol H2置于5 L密闭容器合成氨反应,经过2min后达到平衡时测得混合气体中含NH3的体积百分比为20%,求:(1)混合气体中含H2的体积百分比;
(2)反应前后容器内的压强比; (3)N2和H2的转化率。(4)求H2的反应速率
某温度下,将H2和I2各0.10ml的气态混合物充入10L的密闭容器中充分反应,达到平衡后,测得[H2] ="0.0080mol/L" 。
(1)该反应的平衡常数K。
(2)在上述温度下,该容器中若充入H2和I2蒸汽各0.20mol,试求达到平衡状态时各物质的浓度。
2向一个容积为2L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应: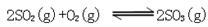 ,经4 s后达到平衡状态,测得SO2的物质的量是3mol,计算:(1)以O2表示的该反应的速率;(2)平衡时SO3的物质的量浓度。
,经4 s后达到平衡状态,测得SO2的物质的量是3mol,计算:(1)以O2表示的该反应的速率;(2)平衡时SO3的物质的量浓度。
某温度下,将4mol N2与8 mol H2的混合气体通入一个1L的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g),达平衡时NH3的浓度为4mol/L。请回答下列问题:
2NH3(g),达平衡时NH3的浓度为4mol/L。请回答下列问题:
⑴计算该温度下的平衡常数K;
⑵计算该条件下N2的转化率;
⑶如起始时N2的物质的量为8mol,其它条件不变,则N2的转化率__________;H2的转化率__________(上述两空选填“增大”、“减小”或“不变”)。
有如下化学反应:2A(g)+B(g)
 2C(g),△H<0。
2C(g),△H<0。
(1)若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足:
n(A)+n(B)=n(C),求A的转化率;
(2)若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,求混合气体中C的体积分数。
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
一定温度下,在密闭容器中,发生反应: 2NO2 2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
求:
(1)NO2的起始浓度? ;
(2)此时NO2的转化率? 。
某温度下在密闭容器中发生如下反应:
2M(g)+N(g) 2E(g)
2E(g)
开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为多少?
在标准状况下,1 mol A气体发生如下反应:
2A(g) B(g)+xC(g)
B(g)+xC(g)
达到平衡时,在混合气中A的体积分数为58.6%,混合气的总质量为46 g,密度为1.772 g·L-1。试计算:
(1)达平衡后,混合气的平均相对分子质量__________。
(2)达平衡后,A的转化率_________________。
(3)C气体的化学计量数x的数值__________________。
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为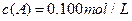 、
、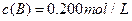 及
及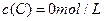 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。
②_______________;
③_______________;
(2)该反应的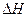 _________0,
_________0,
(以下要写出计算过程)
(3)求:实验②平衡时B的转化率和实验③平衡时C的浓度为
(4)求:该反应进行到4.0min时的平均反应速度率:
实验②: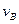
实验③: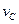
在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 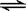 4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
(要求写出计算过程)
某温度下,将氢气和碘蒸气各1mol的气态混合物充入10L的密闭容器中。发生反应H2(g)+I2(g) = 2HI(g)。2分钟后达到平衡后。测得C(H2)=0.08 mol.L-1,求(1)该反应的平衡常数。(2)2分钟内的H2的反应速率 (3)在上述温度下,该容器中若通入氢气和碘蒸气各3mol,求达到平衡后各物质的浓度(提示:K不变)。
在一密闭容器中发生反应: 2A(g)+B(g) E(g)
E(g)
(1)写出该反应的平衡常数表达式___________ ____,已知升高温度时,v(正)>v(逆),此时K值__ __(填“变大”“变小”或“不变”);该反应的△H_____0(填“>”、“=”、“<”);
(2)将1.0mol A和1.0mol B混合后装入2L容器中发生反应,E的物质的量的变化如图所示。
①3分钟内E的平均反应速率为________ _________;
②求此温度下该反应的平衡常数K= (结果保留小数后1位);
③请在图中画出5分钟内A的物质的量变化的曲线;
(3)已知在如图所示的变化中,平衡常数K保持不变,则在5~7min内引起E的物质的量变化的原因可能是____________(填编号)。
①降低了温度 ②升高了温度 ③使用了催化剂 ④增大了容器的体积 ⑤缩小了容器的体积 ⑥减少了A的物质的量。