已知:N2(g)+3H2(g) 2NH3(g);ΔH="-92.4" kJ·mol-1。请回答:
2NH3(g);ΔH="-92.4" kJ·mol-1。请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是 (填字母)。
a.用铁触媒加快化学反应速率 b.采用较高压强(20MPa~50MPa)
c.将原料气中的少量CO等气体净化除去d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。若容器容积恒定,达到平衡时,气体的压强为原来的 ,则N2的转化率a1= ,此时,反应放热 kJ;
,则N2的转化率a1= ,此时,反应放热 kJ;
在密闭容器中充入PCl5(g) PCl3(g)+Cl2(g),反应一段时间后又向体系中加入37Cl2含量较多的氯气,问在没有达平衡之前PCl3(g)中37Cl的含量是否会增加?为什么?
PCl3(g)+Cl2(g),反应一段时间后又向体系中加入37Cl2含量较多的氯气,问在没有达平衡之前PCl3(g)中37Cl的含量是否会增加?为什么?
某温度下在密闭容器中发生如下反应:
2M(g)+N(g) 2E(g)
2E(g)
开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为多少?
在标准状况下,1 mol A气体发生如下反应:
2A(g) B(g)+xC(g)
B(g)+xC(g)
达到平衡时,在混合气中A的体积分数为58.6%,混合气的总质量为46 g,密度为1.772 g·L-1。试计算:
(1)达平衡后,混合气的平均相对分子质量__________。
(2)达平衡后,A的转化率_________________。
(3)C气体的化学计量数x的数值__________________。
将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g) 2H2(g)+O2 (g)
2H2(g)+O2 (g)
2CO(g)+O2 (g) 2CO2 (g)
2CO2 (g)
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_______和_______,或_______和_______。
(2)若平衡时O2和CO2的物质的量分别为n(H2O)="_________" mol(用含a、b的代数式表示)。
在一定条件下可发生反应:2SO2(g)+O2 (g) 2SO3(g)。现取3 L SO2和6 L O2混合,当反应达到平衡后,测得混合气体的体积减小10%。
2SO3(g)。现取3 L SO2和6 L O2混合,当反应达到平衡后,测得混合气体的体积减小10%。
求:(1)SO2的转化率。
(2)平衡混合气体中SO3的体积分数。
在150 ℃时,1 L NO2按下式发生分解反应:2NO2 2NO+O2,当反应达到平衡状态时体积为1.2 L。求该温度下NO2的分解率。
2NO+O2,当反应达到平衡状态时体积为1.2 L。求该温度下NO2的分解率。
如图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓缓通入CO2气体。恒温下,容器甲中活塞缓慢由B向左移动,当移至C处时,容器体积缩小至最小,为原体积的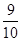 。随着CO2的继续通入,活塞又逐渐向右移动。
。随着CO2的继续通入,活塞又逐渐向右移动。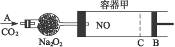
(1)①已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g。此时,通入标准状况下的CO2气体多少升?容器甲中NO2转化为N2O4的转化率是多少?
②活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至B处,则a值必小于0.01。其理由是_________________________________________________________________________。
(2)若改变干燥管中Na2O2的量,可通过调节甲容器的温度及通入CO2的量,使活塞发生从B到C,又从C到B的移动。则Na2O2的质量最小值应大于______________g。
某温度下在密闭容器中发生如下反应:
2M(g)+N(g) 2E(g)
2E(g)
开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为多少?
对于CO(g)+H2O(g) CO2(g)+H2(g),起始时只有CO、H2O(g)且浓度都是4 mol·L-1,达到平衡时,CO的浓度为1 mol·L-1;将H2O(g)的浓度提高到3 mol·L-1,平衡时CO的浓度为0.53 mol ·L-1。求:两次平衡时CO、H2O的转化率和CO2在平衡混合物中百分含量。
CO2(g)+H2(g),起始时只有CO、H2O(g)且浓度都是4 mol·L-1,达到平衡时,CO的浓度为1 mol·L-1;将H2O(g)的浓度提高到3 mol·L-1,平衡时CO的浓度为0.53 mol ·L-1。求:两次平衡时CO、H2O的转化率和CO2在平衡混合物中百分含量。
在一定条件下,可逆反应A2+B2 2C,达到化学平衡状态,经测得平衡时:c(A2)="0.5" mol·L-1,c(B2)="0.1" mol·L-1,c(C)="1.6" mol·L-1,若A2,B2,C的起始浓度分别用a mol·L-1,b mol·L-1,c mol·L-1表示,要维持相同的平衡状态,请计算后完成下列问题:
2C,达到化学平衡状态,经测得平衡时:c(A2)="0.5" mol·L-1,c(B2)="0.1" mol·L-1,c(C)="1.6" mol·L-1,若A2,B2,C的起始浓度分别用a mol·L-1,b mol·L-1,c mol·L-1表示,要维持相同的平衡状态,请计算后完成下列问题:
(1)a、b应满足的关系是什么?
(2)计算a的取值范围。
某化学反应2A(g) B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 时间/min 反应温度/℃ 实验 |
1 |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 1 |
800 |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800 |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800 |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820 |
1.0 |
0.20 |
0.20 |
0.20 |
0.20 |
0.20 |
0.20 |
(1)实验1中,反应在10至20分钟时间内平均化学反应速率为v(A)=_________。
(2)实验2中,A的初始浓度c2="_________" mol·L-1,反应经20 min就达到平衡,可推测实验2中隐含的条件可能是___________________________。
(3)若实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3________v1(填“>”“=”或“<”=,且c3________(填“>”“=”或“<”) 1.0 mol·L-1。
(4)比较实验4和实验1,可推测该反应的正反应是_________(填“吸热”或“放热”)反应。理由是_____________________________________________。