在一定温度下,反应2NO2 N2O4达平衡的标志是 ( )

| A.混合气颜色不随时间的变化 |
| B.数值上v(NO2生成)=2v(N2O4消耗) |
| C.单位时间内反应物减少的分子数等于生成物增加的分子数 |
| D.压强不随时间的变化而变化 |
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是( )

| A.达到化学平衡时,4υ正(O2)= 5υ逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 |
| D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O) |
下列叙述中,不能用平衡移动原理解释的是( )
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
将 1molSO2和1molO2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,SO3为0.3mol。若此时移走0.5molO2和0.5molSO2,则重新达到平衡后,SO3的物质的量为 ( )
| A.0.3mol | B.0.15mol |
| C.小于0.15mol | D.大于0.15mol,小于0.3mol |
完全相同的两个容器甲和乙,已知甲中装有SO2、O2各1克,乙中装有SO2 O2各2克,在同一温度下反应,2SO2(g)+O2(g) 2SO3(g)达平衡时,甲中SO2的转化率为a% ,乙中SO2的转化率为b%,则 ( )

| A.a% > b% | B.a%< b% | C.a%=" b%" | D.无法判定 |
反应mA(固)+nB(气) pC(气)+Q在一定温度下B的体积分数(B%)与压强变化的关系如图2-11所示,下列叙述中正确的是 ( )
 ①m+n>P;②x点表示该反应的正反应速率大于逆反应速率;③n>p;④x点比y点时的反应速率慢。
①m+n>P;②x点表示该反应的正反应速率大于逆反应速率;③n>p;④x点比y点时的反应速率慢。
| A.只有① |
| B.只有②④ |
| C.只有①②④ |
| D.只有①和③ |
一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为: 2SO2 (g) + O2 (g) 2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可以是 ( )
2SO2 (g) + O2 (g) 2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可以是 ( )
| A.4molSO2和2molO2 | B.5molSO2和3molO2 |
| C.4molSO2和4molO2 | D.2molSO2、1molO2和2molSO3 |
一定量的混合气体,在密闭容器中发生如下反应:xA(气)+yB(气) zC(气)达到平衡后,测得A的浓度为0.5 mol·L-1;在恒温下将密闭容器的体积扩大为平衡时的两倍,再达到平衡时,测得A的浓度为0.3 mol·L-1。则下列的叙述正确的是 ( )
| A.x+y>z | B.平衡向左移动 |
| C.B的转化率提高 | D.C的百分含量增大 |
如图所示,反应:X(气)+3Y(气) 2Z(气)+Q(Q>0),在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为 ( )

对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是( )
| A.加入一种反应物 | B.对平衡体系加压 |
| C.升高温度 | D.使用催化剂 |
对可逆反应 4N3(g )+5O2 ( g)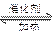 4NO(g)+ 6H2O ( g ) ,下列叙述正确的是
4NO(g)+ 6H2O ( g ) ,下列叙述正确的是
| A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的 n (NH3 ) : n (O 2 ) =" 4:5" |
| B.反应达到平衡后,对体系一直进行加压,平衡总是向逆向移动 |
| C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动 |
| D.当v正(NH3 ) : v正(NO)=" l" : 1 时,说明该化学反应已经达到平衡 |
在固定容积的密闭容器中,可逆反应2X + Y(g) Z(s) 已达到平衡,此时升高温度则气体混合物的密度增大。下列叙述正确的是

| A.若X为非气态,则正反应为吸热反应 |
| B.正反应为放热反应,X为气态 |
| C.在平衡混合物中加入少量Z,则平衡向左移动 |
| D.压强变化对该平衡没有影响 |
在一定体积的密闭容器中放入3升气体R和7升气体Q,在一定条件下发生反应:3R(气)+5Q(气)="=" 4X(气)+nY(气)反应完全后,容器温度不变,混和气体的压强是原来的110%,则化学方程式中的n值是:
| A.2 | B.3 | C.4 | D.5 |