对于反应2SO2+O2 2SO3,下列判断正确的是
2SO3,下列判断正确的是
| A.2体积2SO2和足量O2反应,必定生成2体积SO3 |
| B.其他条件不变,增大压强,平衡必定向左移动 |
| C.平衡时,SO2消耗速率必定等于O2生成速率的两倍 |
| D.平衡时,SO2浓度必定等于O2浓度的两倍 |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应
H2(g)+Br2(g)  2HBr(g) △H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2HBr(g) △H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
| A.a>b | B.a=b | C.a<b | D.无法确定 |
已知 现将体积比为
现将体积比为 的混合气体置于密闭容器中发生上述反应,下列说明反应达到平衡状态的是
的混合气体置于密闭容器中发生上述反应,下列说明反应达到平衡状态的是
| A.体系压强保持不变 |
| B.混合气体颜色保持不变 |
C. 与 与 的体积保持不变 的体积保持不变 |
D.每消耗1mol 同时生成1mol 同时生成1mol |
一定温度下,向a L密闭容器中加入2 mol NO2(g),发生反应:
2NO2  2NO+O2,此反应达到平衡状态时的标志是( )
2NO+O2,此反应达到平衡状态时的标志是( )
| A.混合气体的颜色变浅 |
| B.混合气体的密度不再变化 |
| C.混合气中NO2、NO、O2物质的量之比为2:2:1 |
| D.单位时间内生成2n mol NO,同时生成2n mol NO2 |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时 间变化的曲线如下图所示。下列描述正确的是( )
间变化的曲线如下图所示。下列描述正确的是( )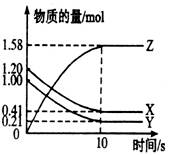
| A.反应开始到10 s,用Z表示的反应速 率为0.158 mol·(L·s)-1 |
| B.反应开始到10 s,X的物质的量浓度 减少了0.79 mol·L-1 |
| C.反应开始到10 s,Y的转化率为79.0% |
D.反应的化学方程式X(g)+Y(g)  z (g) z (g) |
在恒温恒容条件下将一定量NO2和N2O4的混合气体通入密闭容器中,发生反应。反应中各组分浓度随时间变化关系如图。下列说法中,正确的是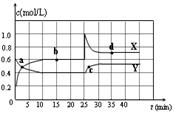
| A.a、b、c、d四个点中,只有b点的化学反应处于平衡状态 |
| B.前10 min内用υ(NO2)表示的化学反应速率为0.04 mol/(L·min) |
| C.25 min时,导致平衡移动的原因是升高温度 |
| D.a点,用υ(NO2)表示的化学反应速率等于用υ(N2O4)表示的化学反应速率 |
某恒容密闭容器中的反应X(g)+Y(g) Z(g) △H<0分两步进行:
Z(g) △H<0分两步进行:
X(g)+Y(g) W(g) △H>0和W(g)
W(g) △H>0和W(g) Z(g) △H<0。下列图示有关该反应的信息不合理的是
Z(g) △H<0。下列图示有关该反应的信息不合理的是

下列图示与对应的叙述相符的是



图a 图b 图c 图d
| A.图a表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图b中曲线表示反应2A(g) + B(g) 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化 |
C.图c表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| D.据图d,若除去CuSO4溶液中的Fe3+ 可向溶液中加入适量CuO至pH在4左右。 |
氮化硅(SiN4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2 Si3N4+6 CO。下列叙述正确的
CO。下列叙述正确的
| A.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂 |
| B.上述反应中每生成1molSi3N4,N2得到12mol电子 |
| C.若已知上述反应为放热反应,升高温度,其平衡常数增大 |
| D.若使压强增大,上述平衡向正反应方向移动 |
【改编】N2O4 2NO2,某温度下相互转化时的量变关系如图所示。下列说法正确的是
2NO2,某温度下相互转化时的量变关系如图所示。下列说法正确的是
| A.0~t1时间内v(N2O4)=0.2mol/(L•min) |
| B.a点时化学平衡向逆反应方向移动 |
| C.t1~t2时间内反应v正(乙)<v逆(甲) |
| D.反应进行到t2时刻,改变的条件可能是加入了催化剂 |
某温度下,在一容积固定的容器中,反应aA(g)+bB(g) hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
A.平衡不移动 B.混合气体的密度不变
C.B的体积分数减少 D.amol/L<c(A)<2amol/L
【改编】在容积为2 L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g) cQ(g),正反应放热。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述错误的是( )
cQ(g),正反应放热。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述错误的是( )

| A.该温度下此反应的平衡常数的值K=25 |
| B.若条件改为恒温恒压,则达平衡时M的转化率小于50% |
| C.相同条件下,若开始时向容器中充入0.4molQ,达到平衡时,M的体积分数等于50% |
| D.若条件改为绝热,则达平衡所需时间更短 |
在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生可逆反应3X(g)+Y(g) 2Z(g),并达到平衡。已知正反应是放热反应,测得X的转化率为37. 5%,Y的转化率为25%,下列有关叙述正确的是
2Z(g),并达到平衡。已知正反应是放热反应,测得X的转化率为37. 5%,Y的转化率为25%,下列有关叙述正确的是
| A.若X的反应速率为0.2 mol·L-1·s-1,则Z的反应速率为0.3 mol·L-1·s-1 |
| B.若向容器中充入氦气,压强增大,Y的转化率提高 |
| C.升高温度,正反应速率减小,平衡向逆反应方向移动 |
| D.开始充入容器中的X、Y物质的量之比为2∶1 |
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)  xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是
xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是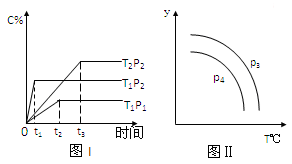
| A.若P3>P4,则y轴表示B的百分含量 |
| B.若P3>P4,则y轴表示混合气体的平均摩尔质量 |
| C.若P3<P4,则y轴表示B的体积分数 |
| D.若P3<P4,则y轴表示混合气体的密度 |
某温度时,在密闭容器中发生反应:aX(g)+bY(s) 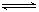 cZ(g)+dW(g),达平衡后,保持温度不变,将压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变,将压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
| A.平衡正移 | B.(a+b)<(c+d) | C.Z的体积分数变小 | D.X的转化率变大 |