[北京]2012届北京市海淀区高三上学期期中练习化学试卷
下列说法中,正确的是
| A.碳素钢、不锈钢、硬铝、黄铜都属于合金 |
| B.正常雨水的pH为5.6,主要是因为溶解了SO2 |
| C.钢化玻璃常用于制造眼镜片、照相机中的透镜等 |
| D.光化学烟雾主要是由于向大气中任意排放CO2、氟氯烃、SO2等产生的 |
下列说法中,不正确的是
| A.胶体中分散质粒子的直径大小在1~100nm之间 |
| B.可以利用过滤的方法分离胶体和溶液 |
| C.可以利用丁达尔效应区分胶体和溶液 |
| D.胶体在一定条件下能稳定存在 |
被誉为“百年新药”的阿司匹林的有效成分是乙酰水杨酸,其结构简式如图所示,下列关于乙酰水杨酸的说法中,不正确的是
| A.可用于治疗胃酸过多 |
| B.分子式为C9H8O4 |
| C.能与乙醇发生酯化反应 |
| D.能与H2发生加成反应 |
在pH=13的溶液中,下列离子能大量共存的是
| A.Na+、NH4+、Cl-、CO32- | B.K+、Ba2+、NO3-、HCO3- |
| C.Na+、K+、SO42-、SiO32- | D.Na+、Cu2+、Br -、AlO2- |
下列各组物质之间不可能实现如图所示转化的是
| 选项 |
X |
Y |
Z |
M |
| A |
O2 |
CO2 |
CO |
C |
| B |
CH3CH2OH |
CH3CHO |
CH3COOH |
O2 |
| C |
NaOH |
NaHCO3 |
Na2CO3 |
CO2 |
| D |
NH3 |
NO |
NO2 |
O2 |
用NA表示阿伏加德罗常数,下列说法中,正确的是
| A.标准状况下,22.4 L NH3中含有的氢原子数为3NA |
| B.标准状况下,足量Na2O2和11.2LCO2反应,转移电子数目为NA |
| C.常温常压下,16g CH4中所含中子数为10NA |
| D.常温常压下,2.8g乙烯中含有碳氢键的数目为0.2NA |
下列说法中,不正确的是
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成了一层致密的氧化膜
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤向蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
| A.①③④⑤ | B.②③④ | C.①③④ | D.①②③④⑤ |
下列离子方程式中,正确的是
| A.向盐酸中加入几滴碳酸钠溶液:H+ + CO32- ="=" HCO3- |
| B.向三氯化铁溶液中加入碘化钾溶液:Fe3+ + 2I- ="=" Fe2+ + I2 |
| C.过量的铁粉加入稀硝酸中:Fe + 4H+ + NO3- ="=" Fe3+ + NO↑+ 2H2O |
| D.等物质的量浓度的明矾溶液与氢氧化钡溶液按体积比1:2混合: |
Al3+ + 2SO42- + 2Ba2+ + 4OH- ="=" AlO2- + 2BaSO4↓+ 2H2O
下列事实可以说明M的非金属性强于N的是
| A.单质与氢气化合的难易程度:M难于N |
| B.最高价氧化物对应水化物的酸性: M弱于N |
| C.简单阴离子的还原性:M强于N |
| D.M的单质能从含N的简单阴离子的溶液中置换出N单质 |
如图是a、b两种固体物质的溶解度曲线,下列说法中,正确的是
| A.a的溶解度大于b的溶解度 |
| B.在t℃时,a、b的饱和溶液中溶质的物质的量浓度相同 |
| C.当a中含有少量b时,可以用冷却结晶法提纯a |
| D.在t℃时,将a、b的饱和溶液升温后,溶质的质量分数:a﹥b |
X、Y是短周期元素,它们可组成化合物XY,下列说法中,正确的是
| A.若Y的原子序数为m,X的原子序数一定是m±6 |
| B.X、Y可以属于同一周期,也可以属于不同周期 |
| C.X与Y一定不属于同一主族 |
| D.XY一定是离子化合物 |
M、R、Q三种短周期元素在元素周期表中的相对位置如图所示,已知M、Q可分别与R形成化合物X和Y,M与R的质子数之和为Q的质子数,下列说法中,正确的是
①M、Q是农作物所必需的营养元素
②X的种类比Y的多
③稳定性:M的氢化物弱于Q的氢化物
④Q的最高价氧化物对应水化物能与M的氢化物形成三种盐
| A.①②③④ | B.①②④ | C.②③ | D.①② |
火法炼铜的原理为:Cu2S + O2 高温 2Cu + SO2,下列说法中 ,正确的是
,正确的是
| A.Cu2S只做还原剂 |
| B.O2发生氧化反应 |
| C.S元素被氧化 |
| D.当0.8mol O2参加反应时,共转移了3.2mol电子 |
在恒温恒容条件下将一定量NO2和N2O4的混合气体通入密闭容器中,发生反应。反应中各组分浓度随时间变化关系如图。下列说法中,正确的是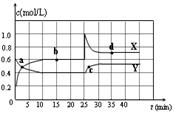
| A.a、b、c、d四个点中,只有b点的化学反应处于平衡状态 |
| B.前10 min内用υ(NO2)表示的化学反应速率为0.04 mol/(L·min) |
| C.25 min时,导致平衡移动的原因是升高温度 |
| D.a点,用υ(NO2)表示的化学反应速率等于用υ(N2O4)表示的化学反应速率 |
已知:A、B、C为中学常见的单质,A为淡黄色固体;D、E、F为中学常见的氧化物,E是具有磁性的黑色晶体;H、K为中学常见的盐;M为一种常见的无色液体。各物质间的转化关系如下图所示(某些条件已略去)。

请回答:
(1)物质K的化学式为 。
(2)物质M的电子式为 。
(3)D可使酸性KMnO4溶液褪色,体现了D物质的 (填字母序号)。
A. 氧化性 B. 还原性 C. 漂白性
(4)C与M在一定条件下反应的化学方程式为 。
(5)先将D气体通入BaCl2溶液中,再通入NH3,实验过程中的现象为 。
(6)H溶液在空气中常期放置会出现红褐色浑浊,请用一个离子方程式表示其变化的原因: 。
(7)A与C可以在一定条件下发生化合反应,其产物中元素A与C的质量比为4:7,该物质是某矿石的主要成分之一,常用于生产G。某化工厂所用矿石样品含杂质25%,若取8.8吨该矿石,假设生产过程中无其他损失,可制得含G 98%的产品 吨。
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O  HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)使用氯气为自来水消毒可以有效 地控制次氯酸的浓度,请结合平衡常数解释原因: 。
地控制次氯酸的浓度,请结合平衡常数解释原因: 。
(3)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(4)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(5)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
①下列溶液能吸收Cl2的是 (填字母序号)。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
②能说明Cl2的氧化性强于I2的实验现象是
。
③请用原子结构知识解释Cl2的氧化性强于I2的原因:
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为 。
(2)该温度下,向2L密闭 容器中充入N2和O2各1mol,平衡时,N2的转化率是 %
容器中充入N2和O2各1mol,平衡时,N2的转化率是 %
(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L
和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向
正反应方向进行”或“向逆反应方向进行”),理由是
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入
一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的
体积分数 (填“变大、“变小”或“不变”)。
A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,B是短周期中金属性最强的元素,C是同周期中阳离子半径最小的元素,D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,E的最外层电子数与内层电子数之比为3﹕ 5。
5。
请回答:
(1)D的元素符号为 。
(2)F在元素周期表中的位置 。
(3)用电子式表示由元素B和F组成的化合物的形成过程: 。(4)B单质与氧气反应的产物与C的 单质同时放入水中,产生两种无色气体,有关的化学方程式为 、 。
单质同时放入水中,产生两种无色气体,有关的化学方程式为 、 。
(5)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为
 。
。
(6)某混合物的稀溶液中,只可能含有B、C、F构成的简单离子或A、E的最高价氧化物对应水化物所电离出来的阴离子。现分别取一定体积的该溶液进行实验。两次每次取200.00mL进行实验。
实验1:取2mL溶液,向其中加入AgNO3溶液有沉淀产生;
实验2:取200mL溶液,向其中加入足量BaCl2溶液后,得干燥沉淀12.54g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g。
请回答:
①根据以上实验,不能判断是否存在的离子有 。
② B的简单离子是否存在? ;若存在,浓度至少为 mol/L(若不存在,则不必回答第二问)。
为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧
化Cu”,并设计实验进行探究。
已知:
| 水解反应 |
平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ |
7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ |
3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ |
3.2 × 10-7 |
请回答:
(1)稀硝酸和Cu反应的化学方程式为 。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe( NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
方案:
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH
的变化,实验记录如下。
| 实验内容 |
实验现象 |
| 甲同学的实验方案 |
溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 |
无明显现象,pH没有明显变化。 |
①根据实验现象写出发生反应的离子方程式: 。
②导致 实验过程中溶液pH略有上升的可能原因是
实验过程中溶液pH略有上升的可能原因是
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号