恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
| 反应时间/min |
n(MgSO4)/mol |
n(CO)/mol |
n(SO2) / mol |
| 0 |
2.0 |
2.0 |
0 |
| 2 |
|
0.8 |
|
| 4 |
|
|
1.2 |
| 6 |
|
1.2 |
2.8 |
下列说法正确的是
A.0~2 min内的平均速率为υ(CO)=0.6 mol/(L·min)
B.4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2
C.若升高温度,反应的平衡常数变为1.0,则正反应为放热反应
D.其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)="0.6" mol
如右图中的曲线是表示其他条件一定时,2NO+O2 2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 ( )
2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 ( )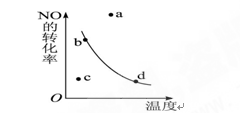
| A.a | B.b | C.c | D.d |
可逆反应2NO2  2NO+O2在体积不变的密闭容器中进行,下列能说明该反应达到最大限度的是 ①单位时间内生成n mol O2的同时生成2n molNO ②单位时间内生成n mol O2的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ( )
2NO+O2在体积不变的密闭容器中进行,下列能说明该反应达到最大限度的是 ①单位时间内生成n mol O2的同时生成2n molNO ②单位时间内生成n mol O2的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ( )
| A.①④ | B.②④ | C.①③④ | D.②③④⑤ |
下列方法中可以说明2HI(g) H2(g)+I2(g)已达到平衡的是( )
H2(g)+I2(g)已达到平衡的是( )
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分组成w(HI)=w(I2) ④反应速率v(H2)=v(I2)=1/2v(HI)时
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1时 ⑥温度和体积一定时,容器内压强不再变化
⑦温度和体积一定时,某一生成物浓度不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
| A.②③⑤ | B.①④⑦ | C.②⑦⑨ | D.⑧⑨⑩ |
羰基硫(COS)可作为一种蚜虫熏蒸剂,能防止某些昆虫、线虫和蚜虫的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
COS(g)+H2(g) K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
| A.升高温度,H2S浓度增加,表明该反应是吸热反应 |
| B.通入CO后,正反应速率逐渐增大 |
| C.CO的平衡转化率为80% |
| D.反应前H2S物质的量为7mol |
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
在容积不变的密闭容器中发生如下反应2A(g)+B(g) 2C(g) △H<0。某研究小组进行了当其他条件不变时改变某一条件对上述反应影响的研究。下列关于图像的分析正确的是( )
2C(g) △H<0。某研究小组进行了当其他条件不变时改变某一条件对上述反应影响的研究。下列关于图像的分析正确的是( )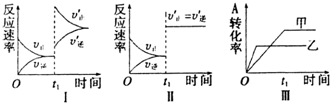
①图I研究的是t1时刻增大B的浓度对反应速率的影响
②图Ⅱ研究的是t1时刻通入氦气增大体系压强对反应速率的影响
③图Ⅱ研究的是催化剂对反应速率的影响,化学平衡不移动
④图Ⅲ研究的是温度对化学平衡的影响,且乙的温度高于甲的温度
| A.①② | B.②③ | C.②③ | D.③④ |
对可逆反应A(气)+2B(气)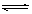 2C(气)△H<0的平衡体系,下列说法错误的是
2C(气)△H<0的平衡体系,下列说法错误的是
| A.使用催化剂,v正、v逆都改变,变化的倍数相同 |
| B.升高温度,v正、v逆都增大,v正增大的倍数小于v逆增大的倍数 |
| C.增大压强,v正、v逆反应的速率都增大,v正增大的倍数大于v逆增大的倍数 |
| D.降低温度,v正、v逆都减小,v正减小的倍数大于v逆减小的倍数 |
密闭容器发生下列反应aA(g)  cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |
在一定温度下,下列叙述说明可逆反应A(g)+2B(g)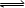
 2C(g) 达到平衡的( )
2C(g) 达到平衡的( )
A.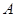 、 、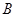 、 、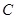 的浓度之比为1:2:2 的浓度之比为1:2:2 |
B.单位时间内消耗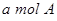 ,同时生成2a mol C ,同时生成2a mol C |
C.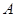 的浓度不再变化 的浓度不再变化 |
| D.混合气体总物质的量为2a mol |
某温度下,反应SO2(g)+ 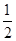 O2(g)
O2(g) SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g) SO2(g) +
SO2(g) + 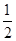 O2(g)的平衡常数K2的值为
O2(g)的平衡常数K2的值为
| A.2500 | B.100 | C.0.02 | D.0.001 |
在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加人a mol及b mol碘化氢(a>b),待反应2HI(g)  I2(g)+H2(g)达平衡后,下列说法正确的是
I2(g)+H2(g)达平衡后,下列说法正确的是
A.从反应开始到建立平衡所需时间:tA>tB
B.平衡时I2的浓度:c(I2)A=c(I2)B
C.平衡时碘蒸气在混合气体中的百分含量:A容器大于B容器
D.平衡时HI的分解率:αA=αB