某温度下在,密闭容器中发生如下可逆反应:2M(g)+N(g)  2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
| A.20% | B.40% | C.60% | D.80% |
反应CO+H2O(g) CO2+H2在1000 K达到平衡时,分别改变下列条件,平衡常数K值发生变化的是
CO2+H2在1000 K达到平衡时,分别改变下列条件,平衡常数K值发生变化的是
| A.将压强减小至原来的一半 | B.将反应温度升高至1200 K |
| C.添加催化剂 | D.增大水蒸气的浓度 |
某一反应在一定条件下的平衡转化率为25.3%,当有一催化剂存在时,其转化率为
| A.大于25.3% | B.小于25.3% | C.等于25.3% | D.无法确定 |
已知反应:2 E (l)  U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如图所示。则下列说法正确的是( )
U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如图所示。则下列说法正确的是( )
| A.该反应的?H > 0 |
| B.b代表50℃下E的Y-t曲线 |
| C.m点(66,0.113)时有:?n (E,20℃) = ?n (E,50℃) |
| D.升高温度可以缩短达到平衡的时间,提高E的转化率 |
化学反应原理中涉及很多常数,下列说法错误的是( )
A.反应 的化学平衡常数表达式为 的化学平衡常数表达式为 |
| B.化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响 |
| C.对于弱电解质的电离平衡常数,当温度一定时,电离平衡常数越小,其酸性越强 |
| D.将AgNO3溶液和KCl溶液混合后,若c(Ag+)·c(Cl-)<KSP(AgCl),则溶液中无沉淀生成 |
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g) H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是 ( )
H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是 ( )
室温下,水的电离达到平衡:H2O H+OH一。下列叙述正确的是
H+OH一。下列叙述正确的是
| A.将水加热,平衡向正反应方向移动,KW不变 |
| B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 |
| C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH—)降低 |
| D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(0H—)=c(H+) |
对于平衡体系mA(g)+nB(g)===pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若改变条件使平衡体系中物质的浓度发生变化,则平衡一定发生移动
下图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
A.正反应是吸热反应
B.若A、B是气体,则D是液体或固体
C.加压使A的转化率变小
D.A、B、C、D均为气体
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
A.c0 (g)+H (g)+H (g) (g)  F=e=CO(g)+H F=e=CO(g)+H 0(g)△H>0 0(g)△H>0 |
B.CH CH CH 0H(g) 0H(g)  CH CH =CH =CH (g)+H (g)+H 0(g)△H>0 0(g)△H>0 |
C.2C H H CH CH CH CH (g)+0 (g)+0 (g) (g)  2C 2C H H CH=CH CH=CH (g)+2H (g)+2H O(g)△H<0 O(g)△H<0 |
D.C0 (g)+2NH (g)+2NH (g) (g)  CO(NH CO(NH ) ) (s)+H (s)+H 0(g)△H<0 0(g)△H<0 |
在0.1mol/L的醋酸溶液中存在如下电离平衡:CH COOH
COOH CH
CH COO
COO +H
+H ,对于 该平衡,下列说法正确的是 ( )
,对于 该平衡,下列说法正确的是 ( )
A.该溶液pH增大时,CH COO COO 浓度可能增大也可能减小 浓度可能增大也可能减小 |
| B.滴加少量的O.1mol/L的盐酸溶液,溶液中氢离子浓度减小 |
| C.加入少量的醋酸钠固体,平衡向正反应方向移动 |
D.加入水稀释c(CH COO COO )·c(H )·c(H )/c(CH )/c(CH COOH)变大 COOH)变大 |
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应: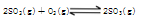 ,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中的转化率是
,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中的转化率是
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
一定条件下,在体积为2L的密闭容器中充入1 mol X和1 mol Y,发生下列反应:2X(g)+Y(g) Z(g),反应经60 s达平衡,生成0.3 mol Z 。下列说法正确的是
Z(g),反应经60 s达平衡,生成0.3 mol Z 。下列说法正确的是
| A.以X浓度变化表示的反应速率为0.005 mol·L-1·s-1 |
| B.将容器体积变为4L,Z的平衡浓度变为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的DH>0 |
某密闭容器中发生如下反应:X(g)+3Y(g)  2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
| A.t2时加入了催化剂 | B.t3时降低了温度 |
| C.t5时增大了压强 | D.t4~t5时间内转化率一定最低 |