下列事实不能用勒夏特列原理解释的是
| A.光照新制的氯水时,溶液的pH逐渐减小 |
B.高温高压有利于N2和H2转化为NH3(N2(g)+3H2(g) 2NH3(g);△H<0) 2NH3(g);△H<0) |
| C.打开汽水瓶时,有大量气泡逸出 |
| D.氨水应密闭保存于低温处 |
某温度时,N2(g)+3H2(g) 2NH3(g)的平衡常数K=a, 则此温度下,
2NH3(g)的平衡常数K=a, 则此温度下,
NH3(g) 
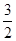 H2(g)+
H2(g)+ N2(g)的平衡常数为
N2(g)的平衡常数为
| A.aˉ½ | B. a a |
C.a½ | D.aˉ2 |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
| A.实验室配制FeCl3溶液时,应向其中加入少量浓盐酸 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| D.热的纯碱溶液去油污效果好 |
t°C时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下该反应的平衡常数表达式为: ,有关该平衡体系的说法正确的( )
,有关该平衡体系的说法正确的( )
| A.升高温度,平衡常数K一定增大 |
| B.增大压强,W(g)质量分数增加 |
C.该反应的化学反应方程式为X+2Y  2Z+2W 2Z+2W |
| D.增大X(g)浓度,平衡向逆反应方向移动 |
关于化学平衡常数K,下列说法不正确的是 ( )
| A.K只随温度的改变而改变 |
| B.K>Q(Q为浓度熵)平衡正向移动 |
| C.正、逆反应的平衡常数数值相同,符号相反 |
| D.K值变化平衡一定发生移动 |
在一定条件下,对于密闭容器中进行的反应:X(g) + Y(g)  2Z(g),下列说法能充分说明该反应已达到化学平衡状态的是( )
2Z(g),下列说法能充分说明该反应已达到化学平衡状态的是( )
| A.X、Y、Z的浓度相等 | B.正、逆反应速率均等于零 |
| C.X、Y、Z在容器中共存 | D.X、Y、Z的浓度均不再改变 |
可逆反应aA(g)+bB(g) cC(g)+dD(g);ΔH同时符合下列两图中各曲线的规律的是( )
cC(g)+dD(g);ΔH同时符合下列两图中各曲线的规律的是( )
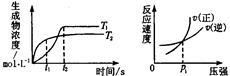
| A.a+b>c+d T1<T2 ΔH<0 | B.a+b>c+d T1<T2 ΔH>0 |
| C.a+b<c+d T1>T2 ΔH<0 | D.a+b>c+d T1>T2 ΔH>0 |
在密闭容器中,加入3mol A和1mol B,一定条件下发生反应
3A(g)+B(g)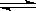 2C(g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持体积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是( )
2C(g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持体积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是( )
| A.6mol A+2mol B |
| B.1.5mol A+0.5mol B+1mol C+0.5mol D |
| C.3mol A+1mol B+2mol C+1mol D |
| D.4mol C+1mol D |
下列有关实验装置进行的相应实验,能达到实验目的的是( )
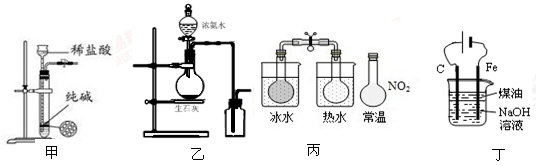
| A.用图甲所示装置控制制取少量的CO2气体 |
| B.用图乙所示装置制取并收集氨气 |
C.用图丙所示装置可以说明反应2NO2(g) N2O4(g)是放热反应 N2O4(g)是放热反应 |
| D.用图丁所示装置可制备Fe(OH)2并能较长时间观察其颜色 |
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g) HCOOH(g)
HCOOH(g)
测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是 ①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数

| A.①② | B.①③ | C.②④ | D.③④ |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
| 容器 编号 |
起始时各物质的物质的量/mol |
达到平衡时体 系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出能量:23.15 kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达到平衡时N2的转化率为25%
D.若容器①体积为0.5 L,则平衡时放出的热量<23.15 kJ
在容积不变的密闭容器中进行反应:
2SO2(g)+O2(g) 2SO3(g) △H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g) △H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
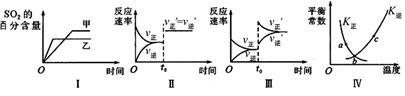
| A.图I表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |
己知某密闭容器中发生反应:X(g)+Y(g)=2W(g)+Z(g) △H<0(Y物质易被液化)。下列有关说法中一定正确的是
| A.若W为有颜色的物质,达到平衡后,增大压强,体系颜色变浅 |
| B.平衡时其它条件不变,升高温度,正反应速率增大程度比逆反应率增大程度小 |
| C.平衡时,其它条件不变,分离出Z,正反应速率加快 |
| D.若在原电池中进行,反应放出的热量不变 |
5L容器中充入2molA(g)和1molB(g),在一定条件下发生反应: 2A(g)+B(g) 2C(g),达平衡时,在相同温度下测得容器内混合气体压强是反应前的5/6,则A的转化率为( )
2C(g),达平衡时,在相同温度下测得容器内混合气体压强是反应前的5/6,则A的转化率为( )
| A.67% | B.50% | C.25% | D.5% |