在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol•L﹣1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol•L﹣1 |
0.05 |
0.05 |
0.1 |
下列说法正确的是
A.反应达到平衡时,X的转化率为60%
B. 反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D.平衡混合物中Y的体积百分含量为50%
对可逆反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H<0,下列叙述正确的是
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x molNH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速减小,逆反应速率增大 |
| D.降温, v (正)和v (逆)都减少,且v (正)减少倍数大于v (逆)减少倍数 |
一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是
| A.若增大压强,平衡向正方向移动,平衡常数变大 |
| B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L |
| C.达到平衡时X浓度为0.04 mol/L |
| D.若升高温度,X的体积分数增大,则该反应的DH>0 |
温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)  nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是
nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是

| A.P1>P2,n<3 |
| B.P1<P2,n=3 |
| C.P1<P2,n>3 |
| D.P1>P2,n>3 |
下列措施或事实不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| C.在合成氨的反应中,降温或加压有利于氨的合成 |
| D.H2、I2、HI平衡混合气加压后颜色变深 |
活性炭可处理大气污染物NO,反应原理:C(s) + 2NO(g) N2(g) + CO2(g)。T℃时,在2L密闭容器中加入0.100 mol NO和2.030 mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol。下列说法不合理的是
N2(g) + CO2(g)。T℃时,在2L密闭容器中加入0.100 mol NO和2.030 mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol。下列说法不合理的是
| A.该温度下的平衡常数是:K=9/16 |
| B.达到平衡时,NO的转化率是60% |
| C.3min末达到平衡,则v( NO ) = 0.01mol/(L·min) |
| D.升高温度有利于活性炭处理更多的污染物NO |
仅根据题中图示得出的结论不合理的是
| |
A |
B |
C |
D |
| 图示 |
 |
 |
 |
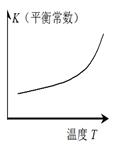 |
| 结论 |
HB为弱酸 |
HF为弱电解质 |
溶解度:AgI<AgCl |
正反应 △H>0 |
反应CO+H2O(g) CO2+H2在1000K达到平衡时,分别改变下列条件,K值发生变化的是( )
CO2+H2在1000K达到平衡时,分别改变下列条件,K值发生变化的是( )
| A.将压强减小至原来的一半 | B.添加催化剂 |
| C.将反应温度升高至1200 K | D.增大水蒸气的浓度 |
下列图示与对应的叙述相符的是
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线) |
| C.图3表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大 |
下列说法正确的是( )
| A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 |
| B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 |
| C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 |
D.一定条件下反应N2+3H2 2NH3达到平衡时,3v正(H2)=2v逆(NH3) 2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
一定温度下,某气体反应达到化学平衡,平衡常数K=c(A)•c2(B)/ c2(E) •c(F),恒容时,若温度适当降低,则F的浓度增加,下列说法中正确的是
A.降低温度,正反应速率减小、逆反应速率增大
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s) A(g)+2B(g)
A(g)+2B(g)
D.该反应的焓变△H>0
下图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )

A.2SO2(g)+O2(g) 2SO3(g);△H<0 2SO3(g);△H<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H<0 4NO(g)+6H2O(g);△H<0 |
C.H2(g)+I2(g) 2HI(g);△H>0 2HI(g);△H>0 |
D.N2(g) +3H2(g) 2NH3(g);△H<0 2NH3(g);△H<0 |
在恒温恒容的密闭容器中,反应A(g)+B(s) 2C(g)达到化学平衡状态的是
2C(g)达到化学平衡状态的是
| A.消耗1molA的同时消耗1mol B |
| B.消耗n molA,同时生成2nmolC |
| C.气体的总体积不变 |
| D.容器内气体密度不变 |