在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g)  nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是
nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是
| A.P1>P2,n<3 | B.P1<P2,n>3 |
| C.P1>P2,n>3 | D.P1<P2,n<3 |
80 ℃时,2 L 密闭容器中充入0.40 mol N2O4,发生反应N2O4 2NO2 ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
2NO2 ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
| 时间/s |
0 |
20 |
40 |
60 |
80 |
100 |
| c(NO2)/mol·L-1 |
0.00 |
0.12 |
0.20 |
0.26 |
0.30 |
0.30 |
下列判断正确的是( )
A.升高温度该反应的平衡常数K减小
B.20~40 s 内,v(N2O4)=0.004 mol·L-1·s1
C.反应达平衡时,吸收的热量为0.30 Q kJ
D.100 s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大
一定条件下反应2AB(g)  A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
有一化学平衡:mA(g)+nB(g) pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是
pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是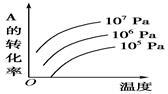
| A.正反应吸热:m+n>p+q |
| B.正反应吸热:m+n<p+q |
| C.正反应放热:m+n>p+q |
| D.正反应放热:m+n<p+q |
某温度下在密闭容器中发生如下反应:2SO2+O2 2SO3(g),若开始时只充入2 molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为
2SO3(g),若开始时只充入2 molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为
| A.20% | B.40% | C.50% | D.60% |
某可逆反应:mA(气)+nB(气) pC(气)(焓变为ΔH),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如下图所示,下列结论正确的是
pC(气)(焓变为ΔH),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如下图所示,下列结论正确的是
| A.m+n>pΔH>0 | B.m+n>pΔH<0 |
| C.m+n<pΔH>0 | D.m+n<pΔH<0 |
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g) C(g)+D(l),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B的物质的量浓度
C(g)+D(l),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B的物质的量浓度
| A.①②④ | B.②③ | C.②③④ | D.只有④ |
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
| A.t2时加入了催化剂 | B.t3时降低了温度 |
| C.t5时增大了压强 | D.t4~t5时间内转化率一定最低 |
在容积不变的密闭容器中,在一定条件下发生反应:2A(?) B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
| A.若正反应为吸热反应,则A为非气态 |
| B.若正反应为放热反应,则A为气态 |
| C.若在平衡体系中加入少量C,则该平衡不移动 |
| D.压强对该平衡的移动无影响 |
已知(HF)2 (g) 2HF(g) △H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如右图所示。下列说法正确的是
2HF(g) △H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如右图所示。下列说法正确的是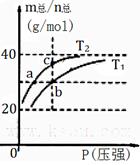
| A.温度: T1<T2 |
| B.平衡常数:K(b)<K(c) |
| C.反应速率:vb>va |
| D.当m总/n总= 30g/mol时,n(HF):n[(HF)2]=2:1 |
下列措施或事实不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.往K2CrO4溶液中加酸,使溶液橙色加深 |
| D.Fe(SCN)3溶液中加入几滴6mol/L NaOH溶液后溶液颜色变浅 |
下列不能用勒夏特列原理解释的是( )
①热的纯碱溶液去油污效果好
②新制的氯水在光照条件下颜色变浅
③在H2、I2(g)和HI组成的平衡体系中,加压,混合气体颜色变深
④饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体
⑤高锰酸钾(KMnO4)溶液加水稀释后颜色变浅
⑥加催化剂有利于氨氧化反应
⑦500℃左右比室温更有利于合成氨的反应
⑧收集氯气用排饱和食盐水的方法
⑨可用浓氨水和氢氧化钠固体快速制取氨气
| A.②③⑤⑥ | B.③⑤⑥⑨ | C.③⑤⑥⑦ | D.④⑥⑦⑨ |
FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq) Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
| A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为 Fe3+(aq)+SCN—(aq)  Fe(SCN)2+(aq) ΔH >0 Fe(SCN)2+(aq) ΔH >0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2 |
| C.反应处于D点时,一定有υ正>υ逆 |
| D.A点与B点相比,A点的c(Fe3+)大 |
对可逆反应A2(g)+B2(g)  2AB(g) 在一定条件下,达到平衡状态的标志是
2AB(g) 在一定条件下,达到平衡状态的标志是
| A.单位时间内生成2n mol AB的同时,生成n mol的B2 |
| B.平衡时容器内的总压强不随时间而变化 |
| C.平衡时容器内各物质的物质的量比为1∶1∶2 |
| D.单位时间内,生成n mol A2的同时,生成n mol的B2 |