一定温度下的反应A(g)+3B(g) 2C(g),下列叙述不能表明它达到化学平衡的是
2C(g),下列叙述不能表明它达到化学平衡的是
A.A、B、C的浓度不再变化
B.混合气体的总物质的量不再变化
C.单位时间内生成a mol A,同时生成3amol B
D.C的生成速率与C的分解速率相等
下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是:
A.2NO2 N2O4(正反应为放热反应) N2O4(正反应为放热反应) |
B.C(固)+CO2 2CO (正反应为吸热反应) 2CO (正反应为吸热反应) |
C.N2+3H2 2NH3(正反应为放热反应) 2NH3(正反应为放热反应) |
D.H2S H2+S(固)(正反应为吸热反应) H2+S(固)(正反应为吸热反应) |
一定条件下反应2AB(g)  A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成n molA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的N2(g)+3H2(g) 2NH3(g),在673K 30MPa下,n(NH3)和n(H2)随时间变化的关系如上图所示。下列叙述正确的是
2NH3(g),在673K 30MPa下,n(NH3)和n(H2)随时间变化的关系如上图所示。下列叙述正确的是
| A.a点的正反应速率比b点的小 |
| B.d点和e点n(N2)不相等 |
| C. c点反应达平衡 |
| D. d点的正反应速率与e点正反应速率相等 |
一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol· L-1、0.3mol· L-1、0.08mol· L-1,则下列判断不正确的是 ( )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol· L-1、0.3mol· L-1、0.08mol· L-1,则下列判断不正确的是 ( )
| A.c1:c2的值不能确定 | B.平衡时,Y和Z的生成速率之比为3:2 |
| C.0.28mol·L-1<c1+c2+c3< 0.56mol·L-1 | D.c1的取值范围为0<c1<0.14 mol·L-1 |
下图表示反应X(g)  4Y(g) +Z(g);在某温度时X的浓度随时间变化的曲线。下列有关该反应的描述正确的是( )
4Y(g) +Z(g);在某温度时X的浓度随时间变化的曲线。下列有关该反应的描述正确的是( )
| A.第6min后,反应就停止了 |
| B.X的平衡转化率为85% |
| C.反应只进行了6min |
| D.在1min内X的平均反应速率为0.7 mol·L-1·min-1 |
T ℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.保持其他条件不变,升高温度,平衡逆向移动 |
| C.反应进行的前3min内,用X表示的反应速率 v(X)=0.1mol·L-1·min-1 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法错误的是
A.反应CO(g)+H2O(g) CO2(g)+H2(g)的△H>0 CO2(g)+H2(g)的△H>0 |
| B.在T2时,若反应进行到状态D,则一定有v正<v逆 |
| C.平衡状态A与C相比,平衡状态A的c(CO)小 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:2H1(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
| A.保持容器体积不变,升高温度,混合气体的颜色逐渐变浅 |
| B.保持容器体积与温度不变,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大 |
| C.保持温度不变,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=25mol/L |
| D.保持容器压强和温度不变,再通入2molHI气体,到达平衡状态后,测得HI的转化率为60% |
将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g) 2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
| |
改变条件 |
新平衡与原平衡比较 |
| A |
升高温度 |
X的转化率变小 |
| B |
增大压强 |
X的浓度变小 |
| C |
充入一定量Y |
Y的转化率增大 |
| D |
使用适当催化剂 |
X的体积分数变小 |
一定温度下可逆反应:+2
 2
2+
;
<0。现将1
和2
加入甲容器中,将4
和2
加入乙容器中,此时控制活塞
,使乙的容积为甲的2倍,
时两容器内均达到平衡状态(如图1所示,隔板
不能移动)。下列说法正确的是( )

| A. |
保持温度和活塞位置不变,在甲中再加入1
|
| B. |
保持活塞位置不变,升高温度,达到新的平衡后,甲中
|
| C. |
保持温度不变,移动活塞
|
| D. |
保持温度和乙中的压强不变,
|
某温度下,可逆反应m A(g) +n B(g)  p C(g)的平衡常数为K,下列对K的说法正确的是
p C(g)的平衡常数为K,下列对K的说法正确的是
| A.K值越大,表明该反应越有利于C的生成,反应物的转化率越大 |
| B.若缩小反应器的容积,能使平衡正向移动,则K增大 |
| C.温度越高,K一定越大 |
| D.如果m+n==p,则K=1 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是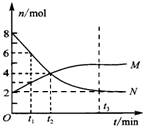
A.反应的化学方程式为:N 2M 2M |
| B.t1分钟内,反应速率: v(M)=2v(N) |
| C.t 2时,正逆反应速率相等,达到平衡 |
| D.平衡时,N的转化率是75% |
T0℃时,在2 L的密闭容器中发生反应:X(g)+Y(g) Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
| A.该反应的正反应是吸热反应 |
| B.T0℃,从反应开始到平衡时:v(X)="0.083" mol·L-1·min-1 |
| C.图a中反应达到平衡时,Y的转化率为37.5% |
| D.T1℃时,若该反应的平衡常数K=50,则T1<T0 |