粗镍经过下列过程可以转化为纯度99.9%的高纯镍,发生的反应是
下列说法正确的是
| A.50~80℃时,适当增大压强,有利于Ni(CO)4的生成 |
| B.180~200℃时,气态的Ni(CO)4 会分解出纯Ni |
| C.提纯过程中,CO(g)的量不断减少 |
| D.温度越高,Ni(CO)4 (g)的转化率越低 |
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s) bZ(g);△H<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。下列说法正确的是( )
bZ(g);△H<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。下列说法正确的是( )
A.用Y表示0~10min内该反应的平均速率为0.05mol/(L·min)
B.根据上图可求得方程式中a:b=2:1 0~10min容器内气体的压强逐渐增大
0~10min容器内气体的压强逐渐增大
D.第13min时曲线变化的原因可能是增加了Z的量
可逆反应2NO2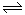 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是①混合物各物质的量的浓度相等 ②单位时间内生成n mol O2的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是①混合物各物质的量的浓度相等 ②单位时间内生成n mol O2的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
| A.①④ | B.②④ | C.①③④ | D.①②③④⑤ |
一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08mol·L-1,则下列判断正确的是
| A.c1:c2="1:3" | B.平衡时,Y和Z的生成速率之比为2:3 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0.04<c1<0.14 mol·L-1 |
在容积一定的密闭容器中,反应2A B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
| A.正反应是吸热反应,且A不是气态 |
| B.正反应是放热反应,且A是气态 |
| C.其他条件不变,加入少量A,该平衡向正反应方向移动 |
| D.改变压强对该平衡的移动无影响 |
在5 mL 0.1 mol·L-1KI溶液中滴加0.1 mol·L-1FeCl3溶液5~6滴后,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是
| A.再滴加AgNO3溶液,观察是否有AgI沉淀产生 |
| B.加入CCl4振荡后,观察下层液体颜色 |
| C.加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生 |
| D.加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g)  2NH3(g),673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( ) 
| A.点e的正反应速率比点d的大 |
| B.点c处反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)相同 |
| D.在给定条件下,t1时刻NH3的含量达到最高 |
在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L | D.SO3为0.25mol/L |
可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡
R(g)+S(g)在恒温下已达到平衡
| A.反应容器内的压强不随时间改变 |
| B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 |
| D.反应容器内的气体总物质的量不随时间变化 |
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
| A.加入一种反应物 | B.升高温度 |
| C.对平衡体系增加压强 | D.使用催化剂 |
下列平衡体系中,升温或减压都使平衡向正反应方向移动的是(△H<0表示放热):
A.N2(g)+3H2(g) 2NH3(g)△H<0 2NH3(g)△H<0 |
B.N2(g)+O2(g) 2NO3(g)△H<0 2NO3(g)△H<0 |
C.C(s)+H2O(g) CO2(g)+H2(g)△H>0 CO2(g)+H2(g)△H>0 |
D.2SO2(g)+O2(g) 2SO3(g)△H<0 2SO3(g)△H<0 |
可以充分说明可逆反应:P(g)+Q(g) R(g)+S(g),在恒温下达到平衡状态的是:
R(g)+S(g),在恒温下达到平衡状态的是:
| A.反应器内压强不随时间而变化 | B.反应器内P、Q、R、S气体共存 |
| C.生成P的速率与生成S的速率相等 | D.生成1molP必定有1molQ生成 |
图中C%表示某反应物在体系中的百分含量,v表示反应速率,p表示压强,t表示反应时间,图(A)为温度一定时压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是( )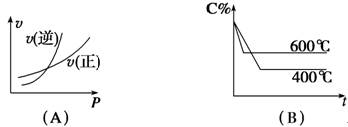
A.4NH3(g)+5O2(g)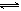 4NO(g)+6H2O(g) △H= -808.7 kJ/mol
4NO(g)+6H2O(g) △H= -808.7 kJ/mol
B.N2O3(g)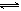 NO2(g)+NO(g) △H= +41.8 kJ/mol
NO2(g)+NO(g) △H= +41.8 kJ/mol
C.3NO2(g)+H2O(l)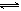 2HNO3(l)+NO(g) △H= -261.3 kJ/mol
2HNO3(l)+NO(g) △H= -261.3 kJ/mol
D.CO2(g)+C(s)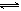 2CO(g) △H= +171.4kJ/mol
2CO(g) △H= +171.4kJ/mol