已知图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g)△H>0的化学反应速率与实践的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g)△H>0的化学反应速率与实践的关系,图二表示的是可逆反应2NO2(g) N2O4(g) △H<0的浓度随时间的变化情况。下列说法中正确的是( )
N2O4(g) △H<0的浓度随时间的变化情况。下列说法中正确的是( )
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.图一t2时改变的条件一定是增大了反应物的浓度 |
| C.图二t1时改变的条件可能是升高了温度或增大了压强 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是
| A.若增大压强,平衡向正方向移动,平衡常数变大 |
| B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L |
| C.达到平衡时X浓度为0.04 mol/L |
| D.若升高温度,X的体积分数增大,则该反应的DH>0 |
升高温度,下列数据不一定增大的是
A.化学反应速率 |
B.弱酸的电离平衡常数Ka |
| C.化学平衡常数K | D.水的离子积常数KW |
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为 反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)能判断该反应已达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为 ℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为 mol,CO的体积分数为 。
在恒容密闭容器中,NH3和NO在一定条件下发生如下反应:
2NH3(g) + NO(g) 2N2(g) + 3H2O(g) ΔH<0 下列有关说法正确的是( )
2N2(g) + 3H2O(g) ΔH<0 下列有关说法正确的是( )
| A.其它条件不变时,使用高效催化剂,不可以使NO的转化率增大 |
| B.平衡时,其它条件不变,充入NH3,平衡向右移动,NH3的转化率增大 |
| C.当混合气体的密度不变了,则反应达到化学平衡状态 |
| D.平衡时,其它条件不变,升高温度可使该反应的平衡常数增大 |
活性炭可处理大气污染物NO,反应原理:C(s) + 2NO(g) N2(g) + CO2(g)。T℃时,在2L密闭容器中加入0.100 mol NO和2.030 mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol。下列说法不合理的是
N2(g) + CO2(g)。T℃时,在2L密闭容器中加入0.100 mol NO和2.030 mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol。下列说法不合理的是
| A.该温度下的平衡常数是:K=9/16 |
| B.达到平衡时,NO的转化率是60% |
| C.3min末达到平衡,则v( NO ) = 0.01mol/(L·min) |
| D.升高温度有利于活性炭处理更多的污染物NO |
下列事实不能用勒夏特列原理解释的是
| A.用排饱和食盐水的方法收集氯气 |
| B.在沸腾的蒸馏水中滴加FeCl3溶液,制Fe(OH)3胶体 |
| C.在FeCl3溶液中加AgNO3溶液,产生白色沉淀 |
| D.向AgCl 和水的悬浊液中加入足量的Na2S溶液并振荡,白色固体转化为黑色固体 |
在密闭容器里,通入x mol H2(g)和y mol N2(g),发生反应3H2(g)+N 2(g)  2 NH3 (g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”),平衡将如何改变?(填“左”“右”或“不移动”)
2 NH3 (g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”),平衡将如何改变?(填“左”“右”或“不移动”)
(1)升高温度 , ;(2)加入催化剂 , ;
(3)充入更多的H2 , ;(4)扩大容器的体积 , ;
(5)容器容积不变,通入氖气 , 。
氯化铁和硫氰化钾在溶液中存在下列平衡:Fe3+(aq)+3SCN-(aq) Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )
Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )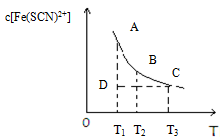
| A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为:Fe3+(aq)+SCN-(aq)=Fe(SCN)2+(aq) △H>0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2 |
| C.反应处于D点时,一定有V正>V逆 |
| D.A点与B点相比,A点的c(Fe3+)大 |
下列变化不能用勒夏特列原理解释的是
| A.向H2S水溶液中加入NaOH有利于S2-增多 |
| B.H2、I2、HI 混合气体加压后颜色变深 |
| C.合成氨时将氨液化分离,可提高原料的利用率 |
| D.新制氯水久置后颜色变浅 |
在一密闭容器中进行如下反应:3H2(气)+N2(气) 2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A.H2为 0.6mol/L、N2为 0. 2mol/L | B.NH3为 0.25mol/L |
| C.N2、NH3均为 0.15mol/L | D.NH3为 0.4mol/L |
可逆反应2SO2 (g)+ O2 (g)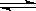 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
| A.若正反应是吸热反应,则A为非气态 |
| B.若正反应是放热反应,则A为非气态 |
| C.在平衡体系中加入少量C,该平衡向逆反应方向移动 |
| D.改变压强对该平衡的移动一定无影响 |
对可逆反应A(g)+2B(g) 3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
A.单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态
B.增大容器的体积,化学平衡不移动,反应速率也不变
C.升高温度使c(B)增大,可知正反应为放热反应
D.加入催化剂,改变了反应历程,但反应的△H不会变