下图是用实验室制得的乙烯(C2H5OH CH2=CH2↑+H2O)与溴水作用制取1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是( )
CH2=CH2↑+H2O)与溴水作用制取1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是( )
| A.装置①和装置③中都盛有水,其作用相同 |
| B.装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同 |
| C.产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出 |
| D.制备乙烯和生成1,2-二溴乙烷的反应类型分别是消去反应和加成反应 |
实验室用含有杂质(FeO、 Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 Ph=5时沉淀完全)。其中分析错误的是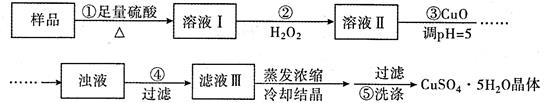
| A.步骤②发生的主要反应为:2Fe2+ +H2O2 +2H+ = 2Fe3+ + 2H2O |
| B.步骤②可用氯水、硝酸等强氧化剂代替 H2O2 |
| C.步骤③用 CuCO3代替CuO也可调节溶液的pH |
| D.步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2 ~ 3次 |
下列实验操作正确的是
| A.实验室制乙烯:将乙醇和浓H2SO4按1:3(体积比)混合(放碎瓷片),迅速升温至140℃ |
| B.实验室制硝基苯:试剂顺序——先加浓H2SO4,再加浓HNO3混合冷却后,最后加苯 |
| C.检验卤代烃消去反应的有机产物:1—溴丙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 |
| D.鉴别矿物油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |
现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
有关说法错误的是
| A.反应Ⅰ原理为CO2 + NH3 + NaCl + H2O =NaHCO3↓ + NH4Cl |
| B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3 |
| C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱 |
| D.CO2的结构式为O=C=O,其中碳氧原子均满足8电子稳定结构 |
汞(熔点-39℃,沸点356℃)是制造电池、电极的重要原料,历史上曾用“灼烧辰砂法”制取汞。目前工业上制粗汞的一种流程图如下。
下列分析错误的是
| A.洗涤粗汞可用5%的盐酸代替5%的硝酸 |
| B.辰砂与氧化钙加热反应时,CaSO4为氧化产物 |
C.“灼烧辰砂法”过程中电子转移的方向和数目可表示为: |
| D.减压蒸馏的目的是降低汞的沸点,提高分离效率 |
下列实验操作正确且能达到相应实验目的的是
| |
实验目的 |
实验操作 |
| A |
称取2.0gNaOH固体 |
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B |
制备Fe(OH)3胶体 |
向沸水中逐滴加入少量氯化铁饱和溶液,继续加热煮沸至液体变为红褐色 |
| C |
检验溶液中是否含有SO42- |
取少量试液于试管中,先加入BaCl2溶液,再滴加稀盐酸,若产生的白色沉淀不溶解,则说明溶液中含有SO42- |
| D |
萃取碘水中的碘 |
将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
从海水中制得的氯化钠除食用外,还可用作工业原料,生成多种含钠或氯的化工产品,利用 +NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图。
+NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图。
饱和食盐水溶液
则相关的说法错误的是
| A.通入的气体:A是CO2,B是NH3 |
| B.NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小 |
| C.步骤(3)的操作为过滤,滤液可作化学肥料 |
| D.步骤(4)中,将晶体加热分解可以得到纯碱 |
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取绿矾(FeSO4·7H2O),设计了如下流程,下列说法不正确的是
| A.溶解烧渣选用足量硫酸,试剂X选用铁粉 |
| B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 |
| C.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O |
| D.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 |
如图是用实验室制得的乙烯(C2H5OH  CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是
| A.装置①和装置③中都盛有水,其作用相同 |
| B.装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同 |
| C.产物可用分液的方法进行分离,1,2﹣二溴乙烷应从分液漏斗的上口倒出 |
| D.制备乙烯和生成1,2﹣二溴乙烷的反应类型分别是消去反应和加成反应 |
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定T i3+至全部生成Ti4+。
i3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________。
⑵检验TiO2·x H2O中Cl- 是否被除净的方法
是否被除净的方法 是______________________________。
是______________________________。
⑶配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。





a b c d e
(4) 滴定终点的现象是___________________________________。
(5) 滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
(6) 判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_________________________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体A(化学式为2Na2CO3·3H2O2)和灰黑色固体B(不溶于水)与水混合反应制得氧气。某同学对A、B两种物质进行探究,实验步骤及现象如下图所示。下列说法错误的是 
A. B在反应①中可能起催化作用 B.设计③的目的是制取氧气
C.第②步分离混合物的方法是过滤 D.白色沉淀D为CaCO3
下列实验可达到实验目的的是
A.将 与NaOH的醇溶液共热制备CH3—CH==CH2 与NaOH的醇溶液共热制备CH3—CH==CH2 |
B.乙酰水杨酸 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 |
| C.向CH3CH2Br中滴入AgNO3溶液以检验溴元素 |
| D.甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 |
以下是在实验室模拟“侯氏制碱法”生产流程的示意图:
则下列叙述错误的是
| A.A气体是NH3,B气体是CO2 |
| B.把纯碱及第Ⅲ步所得晶体与某些固体酸性物质(如酒石酸)混合可制泡腾片 |
| C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 |
| D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶 |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是
| A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 |
| B.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| C.1mol CuSO4在1100℃所得混合气体X中O2可能为0.75mol |
| D.Y可能是葡萄糖 |
实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4•7H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示:下列说法不正确的是
| A.炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O |
| B.气体M的成分是SO2,通入双氧水得到硫酸,可循环使用 |
| C.溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大 |
| D.向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾 |