下图是实验室中制备气体或验证气体性质的装置图

(1)写用发生装置A中制取氯气的化学方程式___________________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:C12>Fe3+则装置B中的溶液的作用是____________;装置D中加的最佳试剂是(填序号)_______________:供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳, a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的___________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为_______________________;
实验2不严谨之处应如何改进____________________________。
FeSO4·7H2O广泛用于医药和工业领域,实验室制备FeSO4·7H2O的流程如下:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_________。
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②_____________________。
(3)FeSO4·7H2O是某些补血剂的主要成分,将1.5 g某补血剂预处理,配成100mL溶液。实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5 g)中铁元素的含量,①配制100 mL 1.200 × 10 —2 mol·L—1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是__________________________;
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是_________________。
a. 稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在__________滴定管中。滴定到终点时的现象为____________。
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下。
| 滴定次数实验数据 |
1 |
2 |
3 |
| V(样品)/mL |
20.00 |
20.00 |
20.00 |
| V(KMnO4)/mL(初读数) |
0.00 |
0.20 |
0.00 |
| V(KMnO4)/mL(终读数) |
15.85 |
15.22 |
14.98 |
该补血剂中铁元素的质量分数为_____________________。
某课外小组探索利用废合金(含有铝、铁、铜)粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,其实验方案如下:

试回答下列问题:
(1)所加试剂①、②分别是___________、____________。
(2)操作①的名称为__________,所用的仪器除铁架台、铁圈和烧杯,还需要的用品有______________。
(3)写出A→D反应离子方程式____________。
(4)滤液E经蒸发浓缩、_________得绿矾晶体,然后再经过滤、洗涤、干燥即得成品。洗涤时,下列试剂最好选用___________。
a.稀H2SO4 b.蒸馏水 c.酒精 d.NaOH溶液
(5)由滤渣F制CuSO4溶液有途径I和途径Ⅱ两种,你认为最佳途径是________,理由是_________________。
氯化铁广泛应用于污水处理、五金蚀刻及有机工业的催化剂、氧化剂和氯化剂等。
(1)现用mg废铁屑(Fe2O3)制取FeCl3· 6H2O晶体,并测定废铁屑中铁的质量分数,实验装置如图(夹持装置略)。反应开始前至A中固体完全消失时,依次进行下列操作:

①缓慢滴加足量盐酸
②关闭弹簧夹K1、打开K2并关闭活塞a
③打开弹簧夹K1、关闭K2并打开活塞a
正确的操作顺序是 (填序号);当A中溶液完全进入烧杯后,烧杯中的现象是 ,相应的离子方程式和化学方程式是: 和 。
。
(2)实验测得B中所得的气体VmL(标准状况),由此计算出该废铁屑中铁的质量分数是 ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是: 。
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是: 。
(3)另取mg废铁屑和CO气体在加热时充分反应到恒重,测得实验后剩余固体质量是wg,由此求出铁的准确质量分数是 (用含m和w的式子表示,无需化简)。
ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂.已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与纯净的氯气反应 2NaClO2+Cl2═2ClO2+2NaCl
如图1是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略).其中E中盛有CCl4液体.

(1)仪器P的名称是
(2)写出装置A中烧瓶内发生反应的化学方程式:
(3)E装置中所盛试剂的作用是
(4)F处应选用的收集装置是图2 (填序号),其中与E装置导管相连的导管口是图2 (填接口字母).

(5)以下是尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸的装置的是如图3的

A.①② B.②③ C.③④ D.②④
(6)若用100mL 2mol•L﹣1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是 (填序号).
A.>0.1mol B.0.1mol C.<0.1mol D.无法判断.
(7)ClO2也可由NaClO3在H2SO4溶液存在下与Na2SO3反应制得.请写出反应的化学方程式: .
实验室常用的几种气体发生装置如图A、B、C所示:

(1)实验室可以用B或C装置制取氨气,如果用C装置,检查C装置气密性是否良好的操作方法是__________________________。
若用B装置制取氨气,用化学方程式表示制取氨气的反应原理_____________________。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的气体发生装置是_______,用离子方程式表示制取氯气的反应原理________________________。
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的______
①CO2 ② NO ③ Cl2 ④ H2 其中在D装置连接小烧杯目的是________________
(4)下图是某同学设计收集氨气的几种装置,其中可行的是_________________。

(5)某兴趣小组同学模拟工业上用离子交换膜法制烧碱的方法,设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为_______________。
②得到的硫酸从 (填A,或D)排放出。
③此时通过阴离子交换膜的离子数 (填大于,小于或等于)通过阳离子交换膜的离子数。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池负极的电极反应式为
硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
(1)写出浸出时铜与稀硝酸反应的离子方程式:______________;
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是____________________。
(3)滤渣c是_____________。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2==2NO2、_____________
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:______________________。
某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:__________________________。
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:①Na2S2O3在酸性溶液中不能稳定存在;
②硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2 → S4O62- + 2I- 。
(Ⅰ)制备Na2S2O3·5H2O
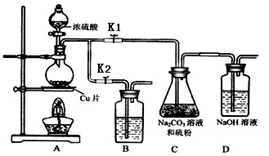
①打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热。圆底烧瓶中发生反应的化学方程式 。
②C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。C中碳酸钠的作用是 。D中可能发生的离子反应方程式为: 。“停止C中的反应”的操作是 。
③过滤C中的混合液。将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
④装置B中盛放的试剂是(填化学式) 溶液,其作用是 。
(Ⅱ)用I2的标准溶液测定产品的纯度
取5.5g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
| 编号 |
1 |
2 |
3 |
| 溶液的体积/mL |
10.00 |
10.00 |
10.00 |
| 消耗I2标准溶液的体积/mL |
19.95 |
17.10 |
20.05 |
滴定时,达到滴定终点的现象是 。
Na2S2O3·5H2O在产品中的质量分数是 (用百分数表示,且保留1位小数)。
高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
在烧瓶中(装置见下图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O)。
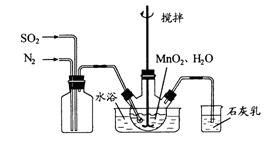
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如下图。
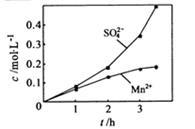
导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①边搅拌边加入 ,并控制溶液pH ;
② ;
③检验SO42-是否被洗涤干净;(实验操作: )
④用少量C2H5OH洗涤;
⑤ 。
某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
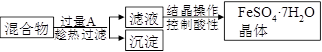
请根据题目要求回答下列问题:
(1)A的化学式为 。
(2)趁热过滤的目的是 。
(3)结晶操作过程中应控制滤液酸性的原因是 。
(4)实验室利用硫酸亚铁铵溶液[(NH4)2Fe(SO4)2]和草酸溶液反应生成草酸亚铁,草酸亚铁晶体(相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
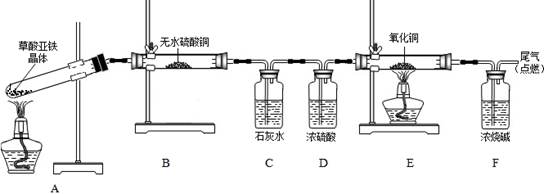
①该装置中最不合理的部分 (填字母),原因是 。
②改用正确装置开始实验,B处变蓝,说明草酸亚铁晶体中有 ;C处有白色沉淀,E处黑色粉末变为红色,说明草酸亚铁分解产生 (填化学式)。
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:

(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为:________。
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有___________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80℃,目的是___________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)。
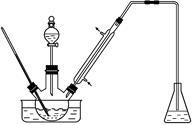
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。其实验步骤为:
附表 相关物质的沸点(101 kPa)
| 物质 |
沸点/℃ |
物质 |
沸点/℃ |
| 溴 |
58.8 |
1,2二氯乙烷 |
83.5 |
| 苯甲醛 |
179 |
间溴苯甲醛 |
229 |
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2二氯乙烷和苯甲醛充分混合后,升温至60 ℃,缓慢滴加经浓H2SO4干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是________,锥形瓶中的溶液应为________。
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为____________。
(3)步骤2中用10% NaHCO3溶液洗涤有机相,是为了除去溶于有机相的____________(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是___________________。
(5)步骤4中采用减压蒸馏(在蒸馏装置上连接真空泵,使系统内压降低,从而使液体化合物在较低温度下沸腾而被蒸出)技术,是为了防止____________。
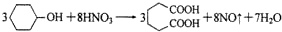
己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据及装置示意图如下:
| 物质 |
密度(g/cm3) |
熔点 |
沸点 |
溶解性 |
| 环己醇 |
0.962g/cm3 |
25.9℃ |
160.8℃ |
20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 |
1.360g/cm3 |
152℃ |
337.5℃ |
在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
实验步骤如下:
I.在三口烧瓶中加入16 mL 50%的硝酸(密度为l.3lg/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。
II.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
Ⅲ.当环己醇全部加入后,将混合物用80℃一90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ,趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重。
请回答下列问题:
(1)本实验所用50%的硝酸物质的量浓度为__________。滴液漏斗的细支管a的作用是 。
(2)仪器b的名称为____ 使用时要从________(填“上口”或“下口”)通入冷水。
(3)NaOH溶液的作用是__________,溶液上方倒扣的漏斗作用是 。
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是 。
(5)进行该实验时要控制好环己醇的滴入速率,防止反应过于剧烈,否则可能造成较严重的后果,试列举两条可能的后果: 。
(6)为了除去可能的杂质和减少产品损失,可分别用__________和____________洗涤晶体。
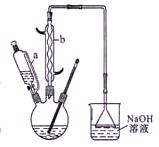
氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。

请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为___ _____(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;下一步操作是:_________(填序号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH2生成。
①写出CaH2与水反应的化学方程式______ ___________
②该同学的判断不正确,原因是______ ___________(用化学方程式表示)
(4)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________。