氯化亚铜(CuCl)广泛用于有机合成、气体吸收、冶金、医药化工等行业。
(1).工业上氯化亚铜可由下列反应制备:
2CuSO4+ Na2SO3 + 2NaCl + Na2CO3® 2CuCl ↓+ 3Na2SO4 + CO2↑。制备过程中需要20% 的CuSO4溶液,配制100g 该CuSO4溶液需要胆矾 g,需要水 g。
(2).实验室可用如下方法制备少量CuCl:取10mL 0.2mol/L CuCl2溶液,加入0.128g铜屑和36.5%的浓盐酸(密度为1.2g/mL)3mL,在密闭容器中加热,充分反应后,得到无色溶液A;将溶液A全部倾入水中,可得到白色的氯化亚铜沉淀。
已知溶液A中只含氢离子和两种阴离子(不考虑水的电离),其中,n(H+)=0.036mol、n(Cl–)=0.032mol。请通过分析和计算,确定溶液A中另一阴离子的化学式和物质的量。
(3).由CO2、O2、CO、N2组成的混合气体1.008L,测得其密度为1.429g/L,将该气体依次通过足量的30%KOH溶液、氯化亚铜氨溶液(可完全吸收O2和CO) (假定每一步反应都能进行完全),使上述液体分别增加0.44g、0.44g(体积和密度均在标准状况下测定)。
①该混合气体的摩尔质量是 g/mol;混合气体中n(CO2): n(CO和N2) = 。
列式计算:
②混合气体中CO的质量是多少?
③最后剩余气体的体积是多少?
下列装置应用于实验室制备氯气并回收氯化锰的实验,能达到实验目的的是
| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中的少量氯化氢 |
| C.用装置丙分离二氧化锰和氯化锰溶液 |
| D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
| 选项 |
a中的物质 |
b中的物质 |
c中收集的气体 |
d中的物质 |
| A |
氯化铵 |
NaOH |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
NaOH溶液 |
| C |
稀硝酸 |
Cu |
NO2 |
H2O |
| D |
浓盐酸 |
MnO2 |
Cl2 |
NaOH溶液 |
下列实验装置进行相应的实验,不能达到实验目的的是( )
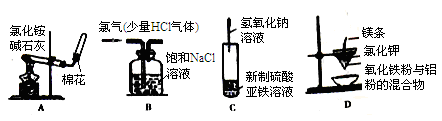
| A.实验室制取并收集氨气 | B.除去Cl2中的HCl气体杂质 |
| C.实验室制取氢氧化亚铁 | D.铝热反应实验 |
下列有关物质性质的应用正确的是( )
| A.液氨汽化时要吸收大量的热,可用作制冷剂 |
| B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| C.生石灰能与水反应,可用来干燥氯气 |
| D.氯化铝是一种电解质,可用于电解法制铝 |
下列气体不能用排空气法收集的是
| A.NO | B.CO2 | C.NH3 | D.NO2 |
实验室用下列仪器和药品制取并收集干燥纯净的氯气。
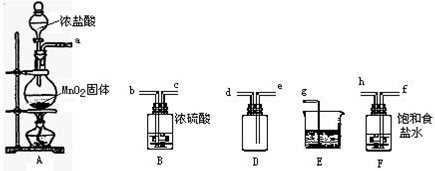
(1) 盛有浓盐酸的仪器名称是___________________。
(2)按气流从左到右,装置正确的连接是:a 接( )、( )接( )、( )接( )、( )接( )(填各接口字母)
(3)装置F 的作用是__________,装置B 的作用是____________。
(4)装置E 中发生反应的化学方程式是____________________。
(5)装置A 中发生反应的化学方程式是_________________________,
若A 中有4.48L 氯气产生(标准状态下),则参加反应的HCl有_______________g。
某化学兴趣小组在加热条件下利用二氧化锰和浓盐酸反应来制取并收集氯气。
(1)若要制取纯净干燥的氯气,应使气体依次通过装有____________和__________的洗气瓶。
(2)某同学不慎将MnO2和KCl粉末混合了,分离该混合物的方法和步骤如下,请补充完整,①先在盛有混合粉末的烧杯中加入适量的水溶解;②将①所得的混合物过滤,该操作所用玻璃仪器有_________、玻璃棒、烧杯;③洗涤、干燥沉淀得到MnO2;将第②步操作所得液体_______________(填操作名称)得到KCl固体。
草酸亚铁为黄色固体,作为一种化工原料, 可广泛用于涂料、染料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产。合成草酸亚铁的流程如下:

(1)配制(NH4)2Fe(SO4)2溶液时,需加入少量稀硫酸,目的是 。
(2)得到的草酸亚铁沉淀需充分洗涤,检验是否洗涤干净的方法是 。
(3)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行加热分解,结果如下图(TG%表示残留固体质量占原样品总质量的百分数)。
①则A→B发生反应的化学方程式为: 。

②已知B→C过程中有等物质的量的两种气态氧化物生成,写出B→C的化学方程式 ;
(4)某草酸亚铁样品中含有少量草酸铵。为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
Ⅰ.准确称量m g样品,溶于少量2mol/L硫酸中并用100mL容量瓶定容。
Ⅱ.取上述溶液20mL,用c mol/L高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液的体积为V1 mL。
Ⅲ.向上述溶液中加入足量Zn粉,使溶液中的Fe3+恰好全部还原为Fe2+。
Ⅳ.过滤,洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液
Ⅴ.用c mol/L KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液的体积V2 mL。
已知:2MnO4-+5H2C2O4+6H+=2Mn2+ +10CO2+8H2O
MnO4-+8H++5Fe2+=5Fe3+ + Mn2++4H2O
回答下列问题:
①若省略步骤Ⅳ,则测定的草酸根离子含量 (填“偏大”、“偏小”或“不变”)。
②m g样品中草酸根离子的物质的量为 (用c,V1,V2的式子表示,不必化简)。
苯甲酸(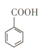 )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率。据此某实验小组设计了如下图的装置来进行上述实验。相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率。据此某实验小组设计了如下图的装置来进行上述实验。相关信息如下:
| |
相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
水中溶解度 |
| 苯甲酸 |
122 |
1.27 |
249 |
微溶 |
| 乙醇 |
46 |
0.789 |
78.3 |
易溶 |
| 苯甲酸乙酯 |
150 |
1.05 |
212.6 |
难溶 |
实验方案为:
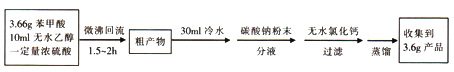

(1)仪器甲的名称为________________。
(2)①往丙中加入药品的顺序为_________________。
A.无水乙醇、浓硫酸、苯甲酸晶体 B.浓硫酸、苯甲酸晶体、无水乙醇
C.苯甲酸晶体、无水乙醇、浓硫酸 D.苯甲酸晶体、浓硫酸、无水乙醇
②若加热反应后发现未加沸石,应采取的正确操作是_____________。
③微沸回流过程中,可以看到乙内的混合试剂的颜色变为_______色。
(3)加入碳酸钠粉末的作用是__________________。
(4)分液要用到的玻璃仪器有__________,粗产物在_______层(填“上”或“下”)。
(5)加热蒸馏若采用下图装置(加热装置已经略去)进行,该装置存在的2个问题为__________、________。
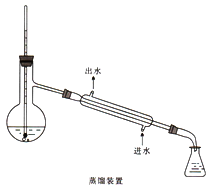
(6)本实验所得到的苯甲酸乙酯产率为______________。
(7)装置乙的作用为____________________
根据题目要求填空:
(1)硫、氮的氧化物是主要的大气污染物,对大气的影响之一是导致酸雨。用化学方程式表示NO2形成酸雨的原因: ,该反应中氧化剂和还原剂的物质的量之比为 。
(2)实验室常用的几种气体发生装置如图A、B、C所示:
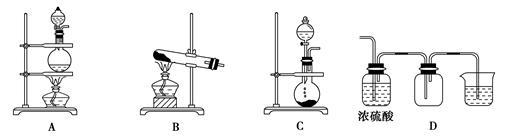
实验室可以用B或C装置制取氨气,如果用B装置,反应的化学方程式是______________;如果用C装置,通常使用的药品是______________(写名称);
‚下图是某学生设计收集氨气的几种装置,其中可行的是______________。
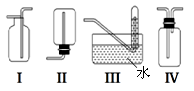
ƒ若用A装置与D装置相连制取并收集X气体,则X可能 是下列气体中的_____________
A.CO2 B.NO C.Cl2 D.H2
写出A装置中反应的离子方程式_______________。
(3)氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
氢化钠(NaH)中Na元素的化合价为+1,在高温下氢化钠(NaH)可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为 。
‚NaH能与水剧烈反应:NaH+H2O===NaOH+H2↑,NaH与液氨(NH3)也有类似反应,该反应的化学方程式为_________________________。
如果有12g NaH参加此反应,则转移电子的物质的量为________mol
(4)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去):
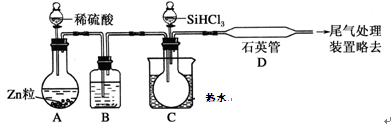
SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:_____________;H2还原SiHCl3过程中若混入O2,可能引起的后果是___________;