北京市丰台区高一上学期期末考试化学试卷
在“空气质量日报”中,不被列入首要污染物的是
| A.二氧化硫 | B.氮氧化物 | C.可吸入颗粒物 | D.二氧化碳 |
当光束通过下列分散系时,能观察到丁达尔效应的是
| A.稀盐酸 | B.CuSO4溶液 | C.酒精溶液 | D.Fe(OH)3 胶体 |
下列有关物质用途的说法中,不正确的是
| A.晶体硅可用于制作光导纤维 | B.过氧化钠可作潜水艇中的供氧剂 |
| C.氢氟酸可用来刻蚀玻璃 | D.漂白粉可用作游泳池的消毒剂 |
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是
| A.Cu | B.Na | C.Fe | D.Al |
下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是
①Al ②Al2O3 ③Ca(OH)2 ④Al(OH)3 ⑤Na2CO3 ⑥NaHCO3
| A.①②⑤⑥ | B.①②③⑤ | C.①②④⑥ | D.②③④⑥ |
下列叙述正确的是
| A.用分液漏斗分液时,上层液体经漏斗下口放出 |
| B.蒸发时,待混合物中的水分完全蒸干后,再停止加热 |
| C.金属钠着火时,立即用水灭火 |
| D.大量氯气泄漏时,迅速离开现场并尽量往高处去 |
用下图装置(夹持、加热装置已略)进行实验,由②中现象不能证实①中反应发生的是
| |
①中实验 |
②中现象 |
| A |
铁粉与水蒸气加热 |
肥皂水冒泡 |
| B |
加热NH4Cl和Ca(OH)2混合物 |
酚酞溶液变红 |
| C |
加热CaCO3固体 |
澄清石灰水变浑浊 |
| D |
加热KClO3和MnO2的混合物 |
用带火星的木条伸入试管②,木条复燃 |
下列变化需要加入适当的氧化剂才能完成的是
| A.Fe → Fe3O4 | B.HNO3 → NO |
| C.H2SO4 → CuSO4 | D.Na2O→NaOH |
下列反应的离子方程式书写正确的是
| A.向稀硫酸中加入氢氧化钡溶液:OH-+ H+ ="=" H2O |
| B.铜与稀硝酸反应:Cu +2NO3- + 4H+===Cu2+ + 2NO2↑+ 2H2O |
| C.向氯化铝溶液中加入过量氨水:Al3+ + 3NH3•H2O ===Al(OH)3↓+ 3NH4+ |
| D.向氯化铁溶液中加入过量铜:Fe3+ +Cu ===Fe +Cu2+ |
下列叙述,正确的是
| A.电解质在电流的作用下发生电离 |
| B.存在自由移动的离子是电解质溶液能导电的原因 |
| C.金属铜能导电,所以铜是电解质 |
| D.硫酸氢钠在水溶液中能电离出氢离子,所以硫酸氢钠属于酸 |
科学家不久前制得一种新型分子O4,2 mol O4和4 mol O2 含有的
| A.电子数相同,分子数不同 | B.质量相同,电子数不同 |
| C.原子数相同,质子数不同 | D.分子数相同,质量不同 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.5.6 g铁与足量稀硫酸反应转移的电子数为0.3 NA |
| B.标准状况下,11.2L水中含有分子的数目为0. 5NA |
| C.500 mL 0.2 mol·L-1CaCl2溶液中氯离子数目为 0.1 NA |
| D.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液,⑥蒸发。正确的操作顺序是
| A.①④②⑤①③⑥ | B.①②⑤④①③⑥ |
| C.①④②⑤③①⑥ | D.①②⑤④③①⑥ |
X、Y、Z、W有如图所示的转化关系,则X、Y可能是
①Na、Na2O ②AlCl3、Al(OH)3 ③Cl2、FeCl3 ④S、SO2
| A.①② | B.②③ |
| C.③④ | D.①②④. |
为区别NaCl、FeCl3和NH4Cl三种溶液,可选用下列试剂中的
| A.KSCN溶液 | B.BaCl2溶液 | C.NaOH溶液 | D.AgNO3溶液 |
下列实验中,所选试剂与装置均合理的是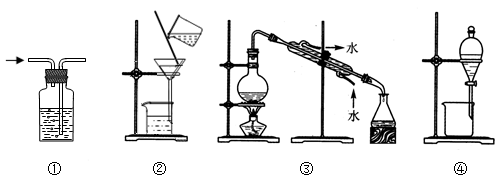
| A.用饱和食盐水除去氯气中的氯化氢,选① |
| B.分离溶液和胶体,选② |
| C.用自来水制取蒸馏水,选③ |
| D.用酒精提取碘水中的碘,选④ |
在反应3 S+6KOH = K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数之比为
| A.2:1 | B.1:2 | C.1:1 | D.3:2 |
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
| A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 |
| B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
| D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
工业上利用硅的氧化物制取硅单质,主要反应为:SiO2 + 2C  Si + 2CO↑。该反应中,还原剂是 (填化学式),被还原的物质是 (填化学式);若反应中消耗了2 mol C,则生成 _____mol Si,转移电子的物质的量为 mol。
Si + 2CO↑。该反应中,还原剂是 (填化学式),被还原的物质是 (填化学式);若反应中消耗了2 mol C,则生成 _____mol Si,转移电子的物质的量为 mol。
某同学用NaCl固体配制200 mL 1 mol/L的NaCl溶液,请回答下列问题。
(1)用托盘天平称取NaCl固体,其质量是______________ g。
(2)实验操作的正确顺序是 (填序号)。
①继续加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;;
②盖好容量瓶瓶塞,充分摇匀;
③把所得溶液冷却至室温后,小心转入容量瓶中;
④称量固体;
⑤用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中
⑥ 把称量好的固体放入小烧杯中,加适量蒸馏水溶解。
(3)下列操作对溶液浓度有何影响 (填“偏高”、“偏低”或“无影响”):
a.配制溶液时,容量瓶未干燥:
b.配制过程中,没有洗涤烧杯和玻璃棒:
c.定容时,俯视刻度线:
d.从配制好的溶液中取出10 mL :
Na2CO3和NaHCO3是两种常见的钠盐。
(1)下列关于Na2CO3和NaHCO3性质的说法中,正确的是___________(填字母)。
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.Na2CO3溶液和NaHCO3溶液均显碱性
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d.等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2的体积相同
(2)实验室利用下图所示装置进行Na2CO3和NaHCO3热稳定性对比实验。请回答:
物质A是 (填化学式),写出其中一种物质受热分解的化学方程式 。
(3)若要除去碳酸氢钠溶液中的碳酸钠,请用化学方程式表示除杂原理 。
A~G是中学化学常见物质,其中A为相同条件下密度最小的气体单质,E为红棕色气体。
(1)G的化学式是 。
(2)A和B反应生成C的化学方程式为 。
(3)检验C可选用的试剂是 (填字母)。
a.湿润的蓝色石蕊试纸 b.湿润的红色石蕊试纸 c.浓盐酸
(4)将盛满气体E的大试管倒扣在盛水的水槽中,发生反应的化学方程式为 ,现象为 。
(5)汽车尾气中含有CO和物质D,一种治理方法是在汽车排气管上装一个催化转化装置,使CO和D反应,生成另外两种无毒气体。该反应的化学方程式是 。
某研究性学习小组欲由硫铁矿烧渣(主要成分为Fe、Fe2O3、SiO2、Al2O3)制备绿矾(FeSO4·7H2O)并测定烧渣中铁元素的含量,流程图如下:
(1)操作a的名称是 。
(2)加入足量试剂X后,发生反应的离子方程式为 、 。
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是 、 。
(4)硫铁矿烧渣中铁元素的质量分数为 。
某实验小组同学为了探究SO2的性质,进行了如下实验(实验前,装置内空气已排尽):
已知:硫酸的沸点是338℃,酒精灯可加热至400℃以上。
主要实验步骤:
①加热试管A直到B、D中均出现大量白色沉淀,熄灭酒精灯;
②将Cu丝上提离开液面;
③从导管F口向装置中通入空气一段时间。
(1)试管A中发生的主要反应的化学方程式为 。
(2)试管B中出现白色沉淀的原因是 。
(3)试管C中溶液褪色,说明SO2具有 (填“漂白性”或“氧化性”或“还原性”),请将该反应的离子方程式补充完整:
(4)试管D中发生反应的离子方程式为 。
(5)下列叙述正确的是 。
a.上下移动铜丝可控制生成SO2的量
b.为确认有CuSO4生成,可向试管A中加水,观察颜色
c.步骤③可使装置中残留气体完全被吸收,避免污染空气
d.熄灭酒精灯后, B中的液体不会倒吸,因为空气可经导管F进入试管A,使压强平衡
 和
和  的是
的是 粤公网安备 44130202000953号
粤公网安备 44130202000953号