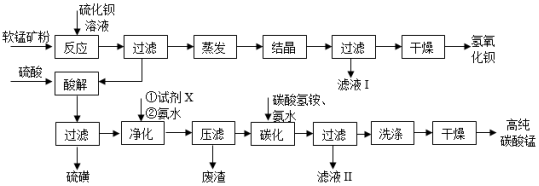
用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3 )和BaS制备高纯MnCO3的工艺流程如图:
已知:MnO2是一种两性氧化物; 25℃时相关物质的Ksp见下表。
物质 |
Fe(OH)2 |
Fe(OH)3 |
Al(OH)3 |
Mn(OH)2 |
Ksp |
1×10﹣16.3 |
1×10﹣38.6 |
1×10﹣32.3 |
1×10﹣12.7 |
回答下列问题:
(1)软锰矿预先粉碎的目的是 ,MnO2 与BaS溶液反应转化为MnO的化学方程式为 。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是 。
(3)滤液Ⅰ可循环使用,应当将其导入到 操作中 (填操作单元的名称)。
(4)净化时需先加入的试剂X为 (填化学式),再使用氨水调溶液的pH,则pH的理论最小值为 (当溶液中某离子浓度c≤1.0×10﹣5mol•L﹣1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为 。
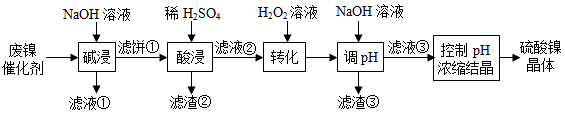
某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO 4•7H 2O ):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |
Ni 2+ |
Al 3+ |
Fe 3+ |
Fe 2+ |
| 开始沉淀时(c=0.01 mol•L ﹣ 1)的pH 沉淀完全时(c=1.0×10 ﹣ 5mol•L ﹣ 1)的pH |
7.2 8.7 |
3.7 4.7 |
2.2 3.2 |
7.5 9.0 |
回答下列问题:
(1)"碱浸"中NaOH的两个作用分别是 。为回收金属,用稀硫酸将"滤液①"调为中性,生成沉淀。写出该反应的离子方程式 。
(2)"滤液②"中含有的金属离子是 。
(3)"转化"中可替代H 2O 2的物质是 。若工艺流程改为先"调pH"后"转化",即  ,"滤液③"中可能含有的杂质离子为 。
,"滤液③"中可能含有的杂质离子为 。
(4)利用上述表格数据,计算Ni(OH) 2的K sp= (列出计算式)。如果"转化"后的溶液中Ni 2+浓度为1.0mol•L ﹣ 1,则"调pH"应控制的pH范围是 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH.写出该反应的离子方程式 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是 。
下列有关实验的操作正确的是( )
| |
实验 |
操作 |
| A |
配制稀硫酸 |
先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B |
排水法收集 分解产生的 |
先熄灭酒精灯,后移除导管 |
| C |
浓盐酸与 反应制备纯净 |
气体产物先通过浓硫酸,后通过饱和食盐水 |
| D |
萃取碘水中的 |
先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A |
B. | B |
C. | C |
D. | D |
胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有________(填标号)。
| A. |
烧杯 |
B. |
容量瓶 |
C. |
蒸发皿 |
D. |
移液管 |
(2)将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为___________,与直接用废铜和浓硫酸反应相比,该方法的优点是_________。
(3)待 完全反应后停止加热,边搅拌边加入适量 ,冷却后用 调 为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、________、乙醇洗涤、________,得到胆矾。其中,控制溶液 为3.5~4的目的是_________,煮沸 的作用是_________。
(4)结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为_________(写表达式)。
(5)下列操作中,会导致结晶水数目测定值偏高的是________(填标号)。
| A. |
①胆矾未充分干燥 |
| B. |
②坩埚未置于干燥器中冷却 |
| C. |
③加热时有少胆矾迸溅出来 |
次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的离子方程式为 ;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是 。
(2)二氯异氰尿酸钠优质品要求有效氯大于60%.通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为
C3N3O3Cl2﹣+H++2H2O═C3H3N3O3+2HClO
HClO+2I﹣+H+═I2+Cl﹣+H2O I2+2S2O32﹣═S4O62﹣+2I﹣
准确称取1.1200g样品,用容量瓶配成250.0mL溶液:取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol•L﹣1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①通过计算判断该样品是否为优质品。
(写出计算过程,该样品的有效氯 100% )
②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值 ( 填“偏高”或“偏低”)。
下列实验操作能达到实验目的是( )
| |
实验目的 |
实验操作 |
| A. |
制备Fe(OH) 3胶体 |
将NaOH浓溶液滴加到饱和FeCl 3溶液中 |
| B. |
由MgCl 2溶液制备无水MgCl 2 |
将MgCl 2溶液加热蒸干 |
| C. |
除去Cu粉中混有的CuO |
加入稀硝酸溶液,过滤、洗涤、干燥 |
| D. |
比较水与乙醇中氢的活泼性 |
分别将少量钠投入到盛有水和乙醇的烧杯中 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如图:
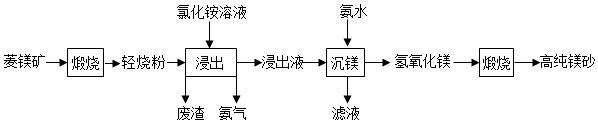
已知浸出时产生的废渣中有SiO2、Fe(OH)3 和Al(OH)3.下列说法错误的是( )
A.浸出镁的反应为MgO+2NH4Cl═MgCl2+2NH3↑+H2O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
《本草衍义》中对精制砒霜过程有如下叙述:"取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之."文中涉及的操作方法是( )
| A. |
蒸馏 |
B. |
升华 |
C. |
干馏 |
D. |
萃取 |
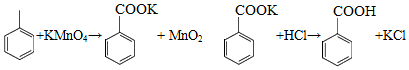
苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
名称 |
相对分子质量 |
熔点/℃ |
沸点/℃ |
密度/(g•mL﹣1) |
溶解性 |
甲苯 |
92 |
﹣95 |
110.6 |
0.867 |
不溶于水,易溶于乙醇 |
苯甲酸 |
122 |
122.4(100℃左右开始升华) |
248 |
﹣﹣ |
微溶于冷水,易溶于乙醇、热水 |
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5mL甲苯、100mL水和4.8g (约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0g。
(3)纯度测定:称取0.122g粗产品,配成乙醇溶液,于100mL容量瓶中定容。每次移取25.00mL溶液,用0.01000mol•L﹣1的KOH标准溶液滴定,三次滴定平均消耗21.50mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为 (填标号)。
A.100mL B.250mL C.500mL D.1000mL
(2)在反应装置中应选用 冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是 。
(3)加入适量饱和亚硫酸氢钠溶液的目的是 ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理 。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是 。
(6)本实验制备的苯甲酸的纯度为 ; 据此估算本实验中苯甲酸的产率最接近于 (填标号)。
A.70% B.60% C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中 的方法提纯。
氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景。通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):

Ⅰ.将浓 、 、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入 粉末。塞好瓶口。
Ⅱ.转至油浴中, 搅拌1小时。缓慢滴加一定量的蒸馏水。升温至 并保持1小时。
Ⅲ.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加 至悬浊液由紫色变为土黄色。
Ⅳ.离心分离,稀盐酸洗涤沉淀。
Ⅴ.蒸馏水洗涤沉淀。
Ⅵ.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
(1)装置图中,仪器a、c的名称分别是 、 ,仪器b的进水口是 (填字母)。
(2)步骤Ⅰ中,需分批缓慢加入 粉末并使用冰水浴,原因是 。
(3)步骤Ⅱ中的加热方式采用油浴,不使用热水浴,原因是 。
(4)步骤Ⅲ中, 的作用是 (以离子方程式表示)。
(5)步骤Ⅳ中,洗涤是否完成,可通过检测洗出液中是否存在 来判断。检测的方法是 。
(6)步骤Ⅴ可用 试纸检测来判断 是否洗净,其理由是 。
下列实验过程可以达到实验目的的是( )
| 编号 |
实验目的 |
实验过程 |
| A |
配制 的溶液 |
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 |
| B |
探究维生素C的还原性 |
向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
| C |
制取并纯化氢气 |
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和 溶液 |
| D |
探究浓度对反应速率的影响 |
向2支盛有5mL不同浓度 溶液的试管中同时加入2mL5% 溶液,观察实验现象 |
| A. | A |
B. | B |
C. | C |
D. | D |
以黄铁矿(主要成分FeS 2)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如图所示。

回答下列问题:
(1)黄铁矿中硫元素的化合价为 。
(2)由炉渣制备还原铁粉的化学方程式为 。
(3)欲得到更纯的NaHSO 3,反应①应通入 (填"过量"或"不足量")的SO 2气体。
(4)因为Na 2S 2O 5具有 性,导致商品Na 2S 2O 5中不可避免地存在Na 2SO 4。检验其中含有SO 4 2 ﹣的方法是 。
(5)一般用 K 2Cr 2O 7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K 2Cr 2O 7溶液滴定其中的Fe 2+。
反应式:Cr 2O 7 2 ﹣+6Fe 2++14H +═2Cr 3++6Fe 3++7H 2O
某次实验称取0.2800g样品,滴定时消耗浓度为0.03000mol•L ﹣ 1的K 2Cr 2O 7溶液25.10mL,则样品中铁含量为 %。
双氧水是一种重要的氧化剂、漂白剂和消毒剂.生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
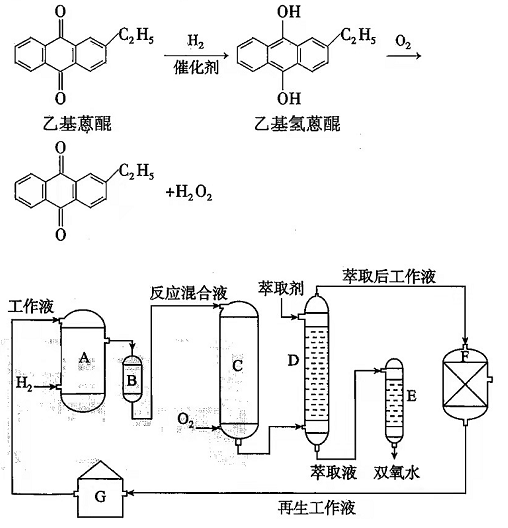
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水.回答下列问题:
(1)蒽醌法制备H 2O 2理论上消耗的原料是________,循环使用的原料是________,配制工作液时采用有机溶剂而不采用水的原因是________.
(2)氢化物A中反应的化学方程式为________.进入氧化塔C的反应混合液中的主要溶质为________.
(3)萃取塔D中的萃取剂是________,选择其作萃取剂的原因是________.
(4)工作液再生装置F中要除净残留的H 2O 2, 原因是________.
(5)双氧水浓度可在酸性条件下用KMnO 4溶液测定,该反应的离子方程式为________,一种双氧水的质量分数为27.5%(密度为1.10g•cm ﹣ 3),其浓度为________mol•L ﹣ 1.
磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
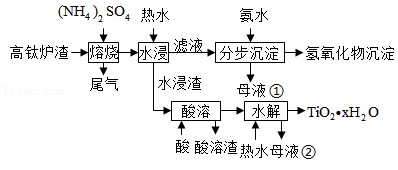
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
| 金属离子 |
|
|
|
|
| 开始沉淀的pH |
2.2 |
3.5 |
9.5 |
12.4 |
| 沉淀完全 的pH |
3.2 |
4.7 |
11.1 |
13.8 |
回答下列问题:
(1)"焙烧"中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐。写出 转化为 的化学方程式 。
(2)"水浸"后"滤液"的 约为2.0,在"分步沉淀"时用氨水逐步调节 至11.6,依次析出的金属离子是 。
(3)"母液①"中 浓度为 。
(4)"水浸渣"在 "酸溶",最适合的酸是 。"酸溶渣"的成分是 、 。
(5)"酸溶"后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是 。
(6)将"母液①"和"母液②"混合,吸收尾气,经处理得 ,循环利用。