下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
I、属于非电解质的是 (填序号)Ⅱ、⑴NaHCO3是一种 (填“强”或“弱”)电解质;
⑵写出HCO3―水解的离子方程式: ;
⑶常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、H2CO3、CO32―、OH―五种微粒的浓度由大到小的顺序为: 。
⑷常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
Ⅲ 、Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
⑴溶液中由水电离出c(OH―)=______________;
⑵与某浓度盐酸溶液按体积比(碱与酸之比)1: 9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
某温度(t ℃)时,水的离子积为KW=1.0×10-13mol2·L-2,则该温度(填“大于”、“小于”或“等于”)________25 ℃,其理由是_______________________________________。
若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是___________________________________。
(2)若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是__________________________________________。
25℃时,如果取0.5mol/LHA溶液与0.5mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得pH=10。试回答以下问题:
(1)混合溶液中由水电离出的c(H+)_______0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)用方程式解释为什么混合后溶液的pH﹥7
(3)求出混合 溶液中下列算式的计算结果(填具体数字):c(A-)+c(HA)= mol/L;
溶液中下列算式的计算结果(填具体数字):c(A-)+c(HA)= mol/L;
c(OH-)-c(HA)= mol/L。
(1)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c(Na+)> c(CN-),用“>、<、=”符号填空
①溶液中c(OH -) c(H +)②c (HCN) c(CN-)
(2)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是:
(A)逐渐减小;(B)逐渐增大;(C)先逐渐增大,而后减小;(D)先逐渐减小,而后增大
(3)pH值相同的HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/LNaOH(aq)中和,消耗NaOH(aq)最多的是 。
③反应开始时,反应速率 。
A、HCl最快 B、H2SO4最快 C、CH3COOH最快 D、一样快
(4)某温度下,纯水中的c(H+)= 2.0×10-7 mol/L,则此时c(OH -)= mol/L。相同条件下,测得① NaHCO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。它们的物质的量浓度由大到小的顺序是 。
运用相关原理,回答下列各小题:
已知:NaHSO4在水中的电离方程式为 NaHSO4=Na+ + H+ + SO42-
(1)常温下,pH=5的NaHSO4溶液中水的电离程度 pH=9的NH3·H2O中水的电离程度。(填 “>”、“=”或“<”)
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则[Na+]+[NH4+] 2[SO42-](填 “>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。(填“>”、“=”或“<” )
(3)将分别含有MnO4-、Fe3+、Fe2+、I-的四种溶液混合,调节溶液的pH值,使pH=1,
充分反应后:
①若I-离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是 。
②若所得混合液呈紫色,上述四种离子在溶液中一定存在的有 ,
一定不存在的离子有 。
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
表2
请回答下面问题:
(1)CH3COONH4的水溶液呈 (选填“酸性”、“中性”或“碱性”),理由是 。溶液中各离子浓度大小关系是 。
(2)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为 。
、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
| 外加条件 |
平衡移动方向 |
C(OH -) |
C(CH3COO -) |
| 升温 |
|
不填 |
不填 |
| 加水 |
|
|
不填 |
| 加盐酸 |
不填 |
|
|
| 加少量氢氧化钠固体 |
不填 |
不填 |
|
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答: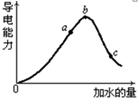
①写出醋酸的电离方程式________________。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
③a、b、c三点中醋酸的电离程度最大的是 。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____ 10C(H+)乙(填“大于”、“小于”或 “等于”),
已知H2A在水中存在以下平衡:H2A H++HA-,HA
H++HA-,HA H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是_____________________________ ___。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
A.c(H+)·c(OH-)=1×10-14 mol2·L-2 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c (Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)  Ca2+(aq)+A2-(aq);ΔH>0。
Ca2+(aq)+A2-(aq);ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是
__________________________________________(用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___________________________________________
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=________。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是____________________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol·L-1 |
| B.若V1=V2,反应后溶液的pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。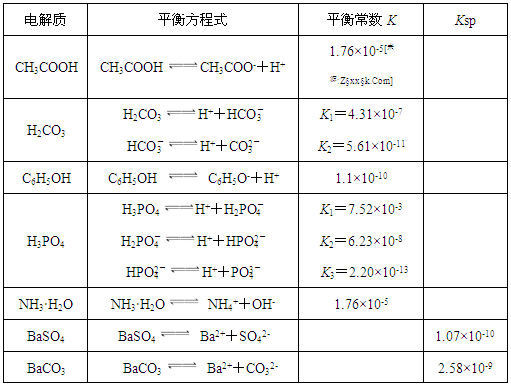
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为 (须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式: ;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是 ;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式 。
(6)Ⅰ.如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题: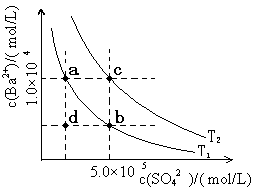
① T1 T2(填>、=、<),
T2温度时Ksp(BaSO4)= ;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为 1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理 次。[提示: BaSO4(s)+ CO32- (aq)
1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理 次。[提示: BaSO4(s)+ CO32- (aq) BaCO3(s)+ SO42- (aq) ]
BaCO3(s)+ SO42- (aq) ]
常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 |
一元酸 |
NaOH |
混合溶液的pH |
| 甲 |
c(HX)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = a |
| 乙 |
c(HY)=c1 mol/L |
c(NaOH)=0.1mol/L |
pH = 7 |
| 丙 |
c(HZ)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = 9 |
| 丁 |
pH=2 HZ |
pH=12 NaOH |
pH = b |
(1)甲组实验中HX为弱酸,a 7(填“<”,“=”或“>”),
混合溶液中离子浓度由大到小顺序为 。
(2)乙组实验中HY为强酸,则HY溶液的pH= 。
(3)丙组实验发生反应的离子方程式为 ,
所得溶液中由水电离出的c (OH-) = mol/L。
(4)丁组实验中b 7(填“<”,“=”或“>”)。
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] •3H2O。
42.2g K4[Fe(CN)6] •3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。试回答下列问题: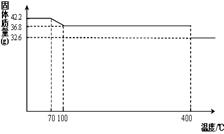
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol•L-1(填“>”、“<”或“=”)。
(4)在25℃下,KCN溶液pH=9,c(K+)-c(CN_)="_______" mol•L-1(用数字表示但不需近似计算)。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-38。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全了;)
胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程: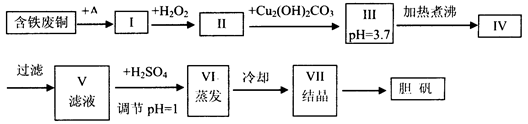
pH值控制可参考下列数据
| 物质 |
开始沉淀时的pH值 |
完全沉淀时的pH值 |
| 氢氧化铁 |
2.7 |
3.7 |
| 氢氧化亚铁 |
7.6 |
9.6 |
| 氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
(1)A可选用________(填字母)
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的___________________________________________________。
(3)Ⅱ中加Cu2(OH)2CO3的目的是___________________________________,
其优点是_____________________________________________________________。
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为___________________________。
(5)V中加H2SO4调节pH=1是为了_________________________________________,
某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是______________,
若你是工程师,将对所加的A物质作何改进?请提出建议______________________。
根据下列事实,完成相关的离子方程式或电离方程式
(1)Na2S溶液使酚酞显红色
(2)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂
(3)常温下,磷酸(H3PO4)溶液pH﹤7
(4)将饱和氯化铵溶液加入到硅酸钠溶液中很快生成白色胶状沉淀,并产生刺激性气味的气体
研究化学反应原理对于生产、生活及环境保护具有重要意义。
(1)工业制硫酸的过程中存在反应: 。
。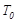 ℃时,将2mol
℃时,将2mol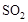 和1.5 mol
和1.5 mol 充入2L密闭容器中发生上述反应,容器中
充入2L密闭容器中发生上述反应,容器中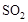 的物质的量随温度变化的曲线如图所示。
的物质的量随温度变化的曲线如图所示。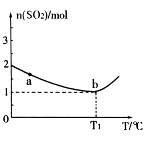
①图中a点的正反应速率 (填写“>”“<”或
“=”)逆反应速率。
②下列条件可以证明上述反应已经达到化学平衡状态的是 (填写序号)
a.单位时间内消耗1mol ,同时生成2mol
,同时生成2mol
b.容器内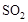 、
、 、
、 的浓度之比为2∶1∶2
的浓度之比为2∶1∶2
c.容器内压强保持不变
d.混合气体的平均相对分子质量保持不变
③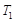 ℃时,上述反应的化学平衡常数K= 。
℃时,上述反应的化学平衡常数K= 。
(2)碳酸铵是一种常用的铵态氮肥,其水溶液显碱性,其原因是 ;溶液中离子浓度关系为 。
。
(3)治理水体重金属离子污染时,首先投入沉淀剂将重金属离子转化为难溶悬浮物,然后再投入氯化铝将污水中的悬浮物除去,从而净化水体,氯化铝的作用是
(用离子方程式表示)。