(14分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是________________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)________0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=________mol/L;c(OH-)-c(HA)=________mol/L。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“>”、“<”或“=”)。
(5)有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.NH4A;C.(NH4)2SO4;D.NH4Cl,按pH由大到小的顺序排列________(填序号)。
(14分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)______________ , ______________ , _______________。
(3)以下各小题均为常温下的溶液
j某溶液中由水电离的c(H+)=10-10mol·L-1,则该溶液的pH为__________。
k盐类水解的逆反应是中和反应 (填“对”或“错”)
lHCO3—溶液呈碱性说明HCO3—的电离能力弱于水解能力 (填“对”或“错”)
m盐溶液显酸碱性,一定是由水解引起的 (填“对”或“错”)
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)  Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 ml蒸馏水 ②100 mL 0.3 mol·lL-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为_______________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
有A、B、C、D四种强电解质,它们在水中可电离出下列离子(每种物质只含一种阳离子和一种阴离子,且互不重复)。
| 阳离子 |
Na+、K+、Ba2+、NH4+ |
| 阴离子 |
SO42-、Cl-、OH-、CH3COO- |
已知:
①A、C溶液的pH均大于7,B溶液的pH小于7;D溶液焰色反应显黄色。
②C溶液与D溶液混合后生成白色沉淀;B溶液与C溶液混合后生成有刺激性气味的气体。
(1)B中阳离子是(填化学式) 。
(2)写出C溶液与D溶液反应的离子方程式: 。
⑶25℃时,pH=9的A溶液和pH=9的C溶液中水的电离程度小的是 (填A或C的化学式)。
⑷25℃时,用惰性电极电解 D 的水溶液,一段时间后溶液的pH_____7(填“>”、“<”或“=”)。
⑸将等体积等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为 。
⑹25℃时,在一定体积0.2 mol · L—1的C溶液中,加入一定体积的0.1 mol · L-1的盐酸时,混合溶液的pH=13。若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是_ _
(Ⅰ)现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)
某化学实验小组探究市售食用白醋中醋酸的的准确浓度,取25.00mL某品牌食用白
醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)左图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,
A处的刻度为25,滴定管中液面读数应为 mL。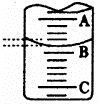
(2)为了减小实验误差,该同学一共进行了三次实验,假设每次
所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实
验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,
其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第一次滴定用的锥形瓶未润洗
D.滴定结束时,俯视读数
(3)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= 。
(Ⅲ)
已知:在25时H2O H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)
的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将
(填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠
的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系
为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)若由pH=3的HA溶液V1mL与pH=11的NaOH{溶液V2 mL。混合而得,则下列说法不正确的是____________。
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中
能生成沉淀,原因是
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= 。