下列叙述正确的是( )
| A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大 |
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。如图是溶液分别滴定
溶液和
溶液的滴定曲线示意图。下列示意图中,能正确表示用
·
溶液滴定
和
混合溶液的滴定曲线的是()

| A. |
|
| B. |
|
| C. |
|
| D. |
|
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
| A. |
在
|
| B. |
|
| C. |
10
|
| D. |
中和体积与
|
已知
的
为2.0×10 -3,将适量
固体溶于100
水中至刚好饱和,该过程中
和
浓度随时间变化关系如下图(饱和
溶液中
=0.034
)。若
时刻在上述体系中加入100
. 0.020
溶液,下列示意图中,能正确表示
时刻后
和
浓度随时间变化关系的是( )
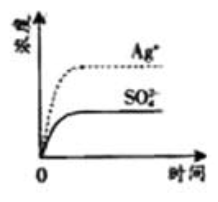
| A. |
|
B. |
|
| C. |
|
D. |
|
某酸性溶液中只有、
、
、
四种离子。则下列描述正确的是( )
| A. |
该溶液由
|
| B. |
该溶液由等物质的量浓度、等体积的
|
| C. |
加入适量的
|
| D. |
加入适量氨水,
|
常温下,某溶液中由水电离出来的=1.0×10-13
,该溶液可能是( )
①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
向三份0.1
溶液中分别加入少量
、
、
固体(忽略溶液体积变化),则
浓度的变化依次为( )
| A. | 减小、增大、减小 | B. | 增大、减小、减小 |
| C. | 减小、增大、增大 | D. | 增大、减小、增大 |
取浓度相同的和
溶液,以3∶2体积比相混合,所得溶液的
等于12,则该原溶液的浓度为()
| A. |
|
B. |
|
C. |
|
D. |
|
实验室现有3种酸碱指示剂,其的变色范围如下:甲基橙:3.1~4.4石蕊:50~8.0酚酞:8.2~10.0用0.1000
溶液滴定未知浓度的
溶液,反应恰好完全时,下列叙述正确的是( )
| A. | 溶液呈中性,可选用甲基橙或酚酞作指示剂 |
| B. | 溶液呈中性,只能选用石蕊作指示剂 |
| C. | 溶液呈碱性,可选用甲基橙或酚酞作指示剂 |
| D. | 溶液呈碱性,只能选用酚酞作指示剂 |
已知乙酸()的酸性比甲酸(
)弱,在物质的量浓度均为0.1
的
和
混合溶液中,下列排序正确的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
向体积为的
溶液中加入体积为
的
溶液,下列关系错误的是()
| A. |
|
| B. |
|
| C. |
|
| D. |
|
有4种混合溶液,分别由等体积0.1的2种溶液混合面成:①
与
;②
与
③
与
④
与
 下列各项排序正确的是
下列各项排序正确的是
| A. |
|
B. |
|
| C. |
溶液中:①>③>②>④ |
D. |
|
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
用0.10的盐酸滴定0.10
的氨水,滴定过程中不可能出现的结果是()
| A. |
|
| B. |
|
| C. |
|
| D. |
|
现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是()

| A. | ④①②⑤⑥③ | B. |
④①②⑥⑤③ 

|
C. | ①④②⑥③⑤ | D. | ①④②③⑥⑤ |