下列叙述正确的是( )
| A.含1 mol溶质的任何溶液,物质的量浓度一定相等 |
| B.配制1 mol·L-1 NaCl溶液1 L,其方法是:将58.5 g NaCl溶于1 L水中即可 |
| C.体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数一定相同 |
| D.1 L 0.5 mol·L-1 CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1 |
某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1则溶液中Al3+和 SO42-的离子个数比为( )
| A.1∶2 | B.1∶4 | C.3∶4 | D.3∶2 |
某温度下,100g饱和氯化钠溶液中含有氯化钠26.5g。若向此溶液中添加3.5g氯化钠和6.5g水,则所得溶液的溶质质量分数是
| A.30% | B.100% |
| C.26.5% | D.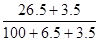 ×100% ×100% |
下列各物质溶液中,指定微粒浓度之间的关系不正确的是( )
| A.饱和NH4Cl溶液中:c(H+)+ c(NH4+)= c(Cl―)+ c(OH―) |
| B.0.1mol/LNaHCO3溶液中:c(HCO3―)+ c(CO32―)+ c(H2CO3)=0.1mol/L |
| C.饱和NaHS溶液中:c(Na+)> c(HS―)> c(H+)> c(OH―) |
| D.0.1mol/LCH3COONa溶液中:c(CH3COO―)> c(OH―) |
向20 mL NaOH溶液中逐滴加入0.1 mol/L醋酸溶液,滴定曲线如右图所示。下列判断正确的是( )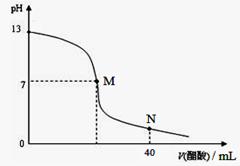
| A.在M点,两者恰好反应完全 |
| B.滴定前,酸中c(H+) 等于碱中c(OH-) |
| C.NaOH溶液的物质的量浓度为0.1 mol/L |
| D.在N点,c(CH3COO-)>c(Na+)>c(H+)>c(CH3COOH) |
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO3→NO。 如果分别用相同物质的量的这些物质氧化足量的KI,得到I2最多的是
| A.Fe3+ | B.MnO4- | C.Cl2 | D.HNO3 |
能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
| A.向水中投入一小块金属钠 | B.将水加热煮沸 |
| C.向水中通入二氧化碳气体 | D.向水中加食盐晶体 |
某溶液中含有Na+、Al3+、NO3-、SO42-(不考虑水中的H+、OH-)四种离子,已知Na+、Al3+、NO3-的个数比为3:2:1,则溶液中Al3+与SO42-的个数比为 [ ]
| A.1∶2 | B.1∶4 | C.3∶4 | D.3∶2 |
下列有关化学原理表达正确的是
| A.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液 |
| B.反应2CO(g)=2C(s) + O2(g)的△H>O、△S<0,可利用该反应来消除CO污染 |
| C.室温下pH=3的盐酸与pH=11的MOH溶液等体积混合后溶液呈碱性,说明MOH为弱碱 |
| D.NH4NO3溶液和HNO3溶液中滴加石蕊都变红色,是因为它们均能电离出H+ |
常温下a mol·L-1 CH3COOH稀溶液和bmol·L-1KOH稀溶液等体积混合,下列判断一定错误的是
| A.若c(OH-)>c(H+),a=b | B.若c(K+)<c(CH3COO-),a<b |
| C.若c(OH-)=c(H+),a>b | D.若c(K+)>c(CH3COO-),a>b |
在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是
| A.v (N2)=0.05mol·L-1·s-1 | B.v (H2)=0.3mol·L-1·min-1 |
| C.v (N2)="0.2" mol·L-1·min-1 | D.v (NH3)="0.3" mol·L-1·min-1 |
某盐的混合物中含有0.2 mol Na+、0.4 mol Mg2+、0.4 mol Cl -,则SO42- 为( )
| A.0.1 mol | B.0.3 mol | C.0.5 mol | D.0.15 mol |
下列溶液中,Na+ 浓度最大的是( )
| A.1mol/L Na2SO4溶液200mL | B.0.9mol/L Na3PO4溶液200mL |
| C.2.5mol/L NaOH 溶液100mL | D.1mol/L NaHCO3溶液300mL |