利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施有 、
。(写出两个措施)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式:
。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 |
Fe3+ |
Mg2+ |
Al3+ |
Cr3+ |
| 开始沉淀时的pH |
2.7 |
—— |
—— |
—— |
| 沉淀完全时的pH |
3.7 |
11.1 |
8 |
9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有 ;但溶液的pH不能超过8,其理由是 。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是 。
(6)写出上述流程中用SO2进行还原的化学方程式 。
(1)0.02mol/L的CH3COOH溶液与0.02mol/L CH3COONa溶液等体积混合,已知该混合溶液中,c(H+)>c(OH-),用“>、<、=”符号填空:
①溶液中c(Na+)_____c(CH3COO-) ② c(CH3COO-)_______ c(CH3COOH)
③ c(CH3COOH)+c(CH3COO-) 0.04 mol/L
(2)酸HnA与碱B(OH)m完全反应生成正盐.
①若HnA为HCl,且该盐溶液的pH<7,用离子方程式说明原因:
②若将0.4mol·L-1的NaOH溶液与0.2mol·L-1的HnA溶液等体积混合后pH=10,
则HnA为 (填序号).
a.一元强酸 b. 一元弱酸 c. 二元强酸 d. 二元弱酸
(3)某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题: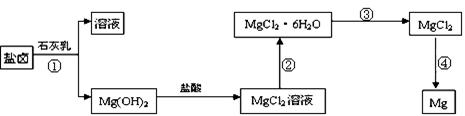
ⅰ.从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2。
ⅱ.过程③的转化需要在HCl气流中加热,HCl的作用是
ⅲ.写出过程④中发生反应的化学方程式
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为 
其中第①步存在平衡: 2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr O
O 和CrO
和CrO 的浓度相同
的浓度相同
b.2v (Cr O
O ) ="v" (CrO
) ="v" (CrO )
)
c.溶液的颜色不变
(3)第②步中,还原1mol Cr O
O 离子,需要 mol的FeSO
离子,需要 mol的FeSO ·7H
·7H O。
O。
(4)第③步生成的Cr(OH) 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:
常温下,Cr(OH) 的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32要使c(Cr3+)降至10
的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32要使c(Cr3+)降至10 mol/L,溶液的pH应调至 。
mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr O
O 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH) 沉淀。
沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
已知:A酸的溶液pH=a,B碱的溶液pH="b "
(1)若A为盐酸,B为氢氧化钠,且a+b=14,二者等体积混合,则溶液的pH= 。若酸碱按体积比为1:10混合后溶液显中性,
则a+b= 。
(2)若A为醋酸,B为氢氧化钡,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol·L-1,B溶液中水电离出的氢离子浓度 为 。mol·L-1
(3)若A为醋酸,B为氢氧化钠,且a+b=14,将体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB,
混合后溶液中的离子浓度关系为c(Na+) c(CH3COO-)
(填“<”“>”或“=”)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,
其水解反应的离子方程式为 。
常温下,将0.1000 mol L-1 NaOH溶液滴入20.00 mL 0.1000 mol L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如下图所示。
(1)HA与NaOH溶液反应的离子方程式是 。
(2)图中②点所示溶液中,下列粒子的浓度关系正确的是 (填序号)。
a.2c(Na+)= c(HA)+c(A-)
b.c(Na+)+c(H+)=c(A-)+c(OH-)
c.c(Na+)>c(A-)>c(H+)>c(OH-)
(3)图中③点所示滴入的NaOH溶液的体积V 20.00 mL(填“>”、“<”或“=”)。
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
| 酸或碱 |
电离常数(Ka或Kb) |
| CH3COOH |
1.8×10-5 |
| HNO2 |
4.6×10-4 |
| HCN |
5×10-10 |
| HClO |
3×10-8 |
| NH3·H2O |
1.8×10-5 |
表1
| 难(微)溶物 |
溶度积常数(Ksp) |
| BaSO4 |
1×10-10 |
| BaCO3 |
2.6×10-9 |
| CaSO4 |
7×10-5 |
| CaCO3 |
5×10-9 |
表2
请回答下面问题:
(1)上述四种酸中,酸性最强的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是 (填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”、“中性”、“碱性”),溶液中各离子浓度大小的关系是 。
(3)物质的量l:l的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为 。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0。0lmol·L-1以上,则溶液中CO32-物质的量浓度应≥ mol·L-1
下列图像能正确反映所对应实验的是 
| A.①为向pH=13的NaOH溶液中不断加水 |
B. ②为向MnO2中加入一定量的H2O2溶液 ②为向MnO2中加入一定量的H2O2溶液 |
| C.③为向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.④为将氨气通入醋酸溶液中 |
某学习小组根据化学知识和下表的数据,设计了表中的实验,以验证酸性:盐酸>碳酸>苯酚>碳酸氢根离子,其中不合理的是 ( )
| 物质 |
电离常数 |
和溶解度(25℃) |
| C6H5OH |
K=1.28×10-10 |
S = 9.3g/100g水 |
| H2CO3 |
K1 =4.3×10-7 |
|
| K2 =5.6×10-11 |
|
| |
组别 |
操作 |
判断依据 |
| A |
盐酸和碳酸 |
往碳酸钙固体中滴加盐酸 |
观察有无气体产生 |
| B |
碳酸与苯酚 |
往苯酚钠饱和溶液中,通入足量CO2 |
观察溶液是否变浑浊 |
| C |
碳酸与苯酚 |
配制同物质的量浓度的碳酸钠溶液和苯酚钠溶液 |
比较溶液的pH |
| D |
HCO3-与苯酚 |
在苯酚悬浊液中,加入过量的 Na2CO3溶液 |
观察悬浊液是否变澄清 |
运用相关原理,回答下列各小 题:
题:
Ⅰ.已知NaHSO4在水中的电离方程式为NaHSO4=Na++ H++ SO4 2-。
2-。
(1)在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填“>”、“=”或“< ”
” 下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
(2)将 20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
0.001 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅱ.已知:在25时 H2O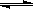 H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH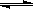
 H++CH3COO--> Ka=1.8×10-5
H++CH3COO--> Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 。当升高温度时,Kh将 (填“增大”“减小”“不变”);
(4)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)
 为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(5)0.9mol·L-1醋酸钠溶液中[OH-]= mol·L-1
在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14、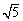 =2.2)
=2.2)
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H (填“增大”、“减小”或“不改变”)。
2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H (填“增大”、“减小”或“不改变”)。
(2)在25℃下,向浓度均 为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀会分步析出。
为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀会分步析出。
首先生成沉淀的离子方程式为 __________________
氨水过量后,生成的沉淀会部分溶解,写出溶解沉淀的离子方程式__________________________.
( 已知25℃时Ksp[Mg(OH)2]=1.8×10-11, KsP[Cu(OH)2]=2.2×10- 20 )
20 )
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中
c(NH4+) = c(Cl-)。则溶液显 _____ 性(填“酸”、“碱”或“中”),请用含a的代数式表示NH3·H2O的电离常数Kb= 。
(4) 在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则v(o2)= mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,再次达到平衡后, n(SO3)的取值范围为________________。
(12分)利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、NH4+、Cl一四种离子,
且c(NH4+)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: 。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是 。
(4)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量
如右图所示,B点溶液的pH=7(假设体积
可以直接相加),则c(HCl)= mol·L-1.
(5)在温度、容积相同的3个密闭容器中,
按下表投入反应物,发生反应(H2(g)+
I2(g) 2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
到平衡时的数据如下表:
下列说法正确的是 。
A. + + =1 =1 |
B.2 = = |
C.a+b=14.9 | D.c1=c2=c3 |

下列说法正确的是
A.常温下,反应4Fe(OH)2(s)+2H2O(1)+O2(g)=4Fe(OH)3(s)能自发进行,则该反应的
B.浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸
C.在等浓度NaCl和NaCrO4稀溶液中滴加AgNO3溶液,分析出AgCl,则KSP(AgCl)<KSP(Ag2CrO4)
D.等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小
现有A、B、C、D四种溶液,它们分别是AlCl3溶液、盐酸、氨水、Na2SO4溶液中的一种,已知A、B 溶液中水的电离程度相同,A、C溶液的PH相同,则下列说法正确的是
A.A为AlCl3溶液,C为盐酸
B.C中加入足量B反应的离子方程式为:Al3++3OH-=Al(OH)3↓
C.A、B等体积混合后,溶液中各离子浓度由大到小的顺序为:
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.溶液中水的电离程度:A=B<C<D
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题 意回答下列问题:
意回答下列问题:
(1)写出酸H2A的电离方程式 。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与2 mol·L-1NaOH溶液等体积混合而得,则溶液M的pH________7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为 。
(3)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为______ ______。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为__________(填“大于”“等于”“小于”或“均有可能”)。
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) 。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)__ ___。
A.氨水与氯化铵发生化学反应 B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),①__ _和_  __两种粒子的物质的量之和等于0.1mol。
__两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多0.05mol。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl- )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系
c(NH4+) c(Cl-)。