由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2 2KMnO4+MnO2↓+2K2CO3
2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
| 物质 |
K2CO3 |
KHCO3 |
K2SO4 |
KMnO4 |
| 溶解度g/100g |
111 |
33.7 |
11.1 |
6.34 |
完成下列填空:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 。(填序号)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
加酸时不宜用硫酸的原因是: ;不宜用盐酸的原因是( )
(2)K2MnO4的转化2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
(3)草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
已知 涉及到的反应:Na2C2O4+ H2SO4→H2C2O4(草酸)+Na2SO4
5H2C2O4+ 2MnO4—+6H+→2Mn2++10CO2↑+ 8H2O
Ⅰ 称取0.80 g的高锰酸钾产品,配成50 mL溶液。
Ⅱ 称取0.2014 gNa2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。消耗高锰酸钾溶液8.48mL,则样品中高锰酸钾的质量分数为 (保留3位小数)。达到滴定终点的标志是 。
(4)加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 。(填“偏高”、“偏低”或“无影响”)
(5)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,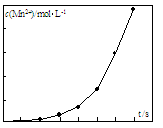
其原因可能为 。
水中因含有机物而具有较高的化学耗氧量。常用酸性KMnO4氧化有机物测其含量。主要操作步骤如下: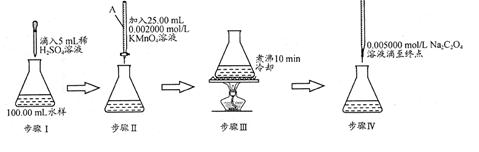
(1)仪器A为 (填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为 。
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42—+ MnO4—+ = Mn2++ CO2↑+
该步骤中KMnO4溶液紫色会逐渐褪去.某探究小组测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.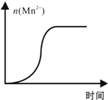
请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00ml,已知滴定后的液面如图所示,请写出滴定前的液面读数 。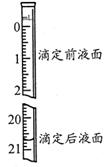
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl—影响
猜想2:配制Na2C2O4标液定容时 。
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl—影响。(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) 。
资料卡片:
1、有机物可被HNO3氧化。
2、AgCl不与酸性KMnO4溶液反应。
3、Ag2C2O4可被酸性KMnO4溶液氧化。
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
Ⅰ.称量4.910g三草酸合铁酸钾晶体,配制成250mL溶液。
Ⅱ.取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,滴加KMnO4溶液至草酸根(C2O42−)恰好全部氧化成二氧化碳,同时MnO4−被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至溶液的黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
Ⅲ.用0.01000mol/L KMnO4溶液滴定步骤Ⅱ所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4−被还原成Mn2+ 。
Ⅳ.重复步骤Ⅱ、步骤Ⅲ操作,滴定消耗0.01000mol/L KMnO4溶液19.98mL
请回答下列问题:
(1)滴定过程中需添加的指示剂是(若不需要请说明理由)
(2)加入锌粉的目的是 。
(3)写出步骤Ⅲ中发生反应的离子方程式 。
(4)实验测得该晶体中铁的质量分数为 ;X= 。
(5)在步骤Ⅱ中,若加入的KMnO4的溶液的量不够,则测得的铁含量 ;(选填“偏低”“偏高”“不变”,下同)若加入的锌粉的量不够,则测的铁的含量 。
(共18分)如图中,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置。
(1)上述装置中有一处错误,请指出是 处(用字母表示)。
(2)通过B是为了除去 ,在B中应加入 ;通过C是为了除去 。
(3)写出D、F中发生反应的化学方程式 、 。
(4)如果A中产生氯气3.36L(标准状况),请计算:
①写出A中发生反应的化学方程式,并标出A中的电子转移情况 。
②消耗MnO2的物质的量 。
③被氧化的HCl的物质的量 。
(15分)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下: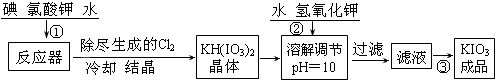
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验所生成的碘时,主要用到的玻璃仪器有 。
(2)从滤液中得到KIO3成品的操作为 ,操作时除不断用玻璃棒搅拌外,还需要注意的事项有
。
(3)某探究学习小组测定加碘食盐中碘的含量,设计的实验步骤如下:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;反应的方程式如下,请配平
KIO3+ KI+ H2SO4 ="==" K2SO4+ I2+ H2O;
③生成的碘单质用Na2S2O3溶液滴定,反应的离子方程式为:I2+2S2O32- ="==" 2I-+S4O62-。
滴定时,选择 为指示剂,眼睛应该注视 ,达到滴定终点时的现象为 ,加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0mL时,恰好反应完全。
(4)该加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:

现称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05000 mol·L-1标准碘溶液进行滴定,初读数为0.10 mL,末读数如右图所示。
(1)冶炼铜的反应为8CuFeS2+ 21O2 高温8Cu + 4FeO + 2Fe2O3+ 16SO2,若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)装置a的作用是 。
| A.有利于空气中氧气充分反应 | B.除去空气中的水蒸气 |
| C.有利于气体混合 | D.有利于观察空气流速 |
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)滴定时,标准碘溶液所耗体积为 mL。用化学方程式表示滴定的原理: 。
(5)通过计算可知,该黄铜矿的纯度为 。
(17分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验: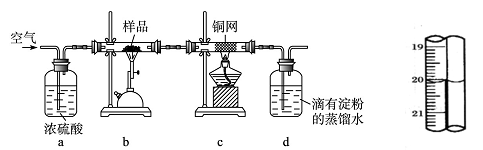
称取研细的黄铜矿样品1.150g,在空气存在的条件下进行煅烧。实验后取d中溶液的1/10置于锥形瓶中,用0.05mo1/L标准碘溶液进行滴定,初读数为0.10mL,终读数如右上图所示。
(1)黄铜矿煅烧的反应为8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2,该反应中被还原的元素是___(填元素符号)。
(2)标准碘溶液应盛放在(填“碱式”或“酸式”)________滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是: 。请用化学方程式表示滴定的原理: 。
(3)滴定终点的读数为 mL;通过计算可知,该黄铜矿的纯度为 。
(4)若去掉c装置,会使测定结果 (填“偏低”“偏高”或“无影响”)。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,可能的原因主要有 。
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)提出猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含有 (填化学式,下同)。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含有 。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:
a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
| |
选用试剂 |
实验现象 |
| 方案1 |
|
|
| 方案2 |
|
|
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为 。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
(15分)过二硫酸钾(K2S2O8)是一种无色结晶,易溶于水,不溶于乙醇,有强氧化性,易分解。实验室制备过二硫酸钾可通过低温电解KHSO4溶液得到。
实验步骤如下:
步骤1.称取KHSO4溶解蒸馏水,倒入大试管,试管浸在冰水浴中(装置见图9),并冷却到5℃以下。
步骤2. 电解2h,每隔约半小时补一次冰
步骤3.过滤
步骤4.
步骤5.干燥、称重
(1)电解时溶液温度控制在5℃以下的原因是 。
(2)电解时阳极反应式为 。电解过程中, 阳极产生微量且能使湿润的KI-淀粉变蓝的单质气体,该气体可能是 (填化学式)。
(3)步骤4操作是 。
(4)取得到的样品0.2500g溶于30mL水,加4gKI,塞住瓶塞,振荡,静止15min,加入1mL冰醋酸,再用cmol·L- 1Na2S2O3溶液滴定。
(S2O82- +3I- =2SO42- +I3-;I3- I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)
①溶解时,加入KI后需塞住瓶塞,其目的是 。
②本实验所用的指示剂为 。
③若本次滴定消耗Na2SO3溶液VmL,由本次结果计算,样品中K2S2O8的纯度为 (用含c、V的代数式表示)。
(5)分析化学上检验Mn2+在Ag+催化下K2S2O8溶液将Mn2+氧化为紫色的MnO4-,该反应的离子方程式为 。
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)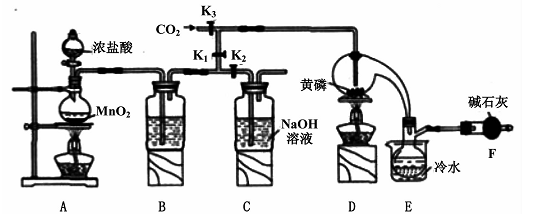
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3和HCl;遇O2会生成POCl3,POCl3溶于PCl3。PCl3、POCl3的熔沸点见下表:
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,E中冷水的作用是 ,F中碱石灰的作用是 。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 。
(4)粗产品中常含有POC13、PCl5等。加入黄磷加热除去PCl5后.通过 (填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml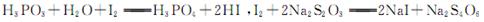 已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。
已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。
I.某兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)已知CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。
将草酸亚铁分解产生的气体依次通过A(澄清石灰水)和B(氯化钯溶液),观察到A中澄清石灰水变浑浊,B中有黑色物质生成。由此说明气体产物中含有 。
(2)将样品草酸亚铁晶体(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。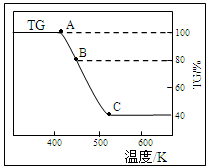
①试确定B点对应固体物质的化学式 ;
②写出B C对应的化学方程式 。
C对应的化学方程式 。
II.某草酸亚铁样品(不含结晶水)中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。
实验方案如下:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.02000 mol/L的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 ml。
试回答下列问题:
(1)高锰酸钾标准液用 滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为 。
(3)在步骤②中,下列操作会引起测定结果偏高的是 。
| A.滴定管在盛装高锰酸钾前未润洗 |
| B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出 |
| C.滴定前读数正确,滴定终点时俯视读数 |
| D.滴定前读数正确,滴定终点时仰视读数 |
(4)0.20g 样品中 FeC2O4的质量分数为 。(不考虑步骤②中的损耗)
化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下方法来制备这种材料并测定这种材料的组成: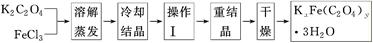
(1)结晶时应将溶液用冰水冷却置于在黑暗处等待晶体的析出,这样操作的原因是:________________________________________________________________________。
(2)操作Ⅰ的名称是______________________。
(3)称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.100 0 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00 mL时恰好完全反应,H2C2O4与酸性KMnO4溶液反应的化学方程式是:__________________________。再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定。当Fe2+完全氧化时,用去KMnO4溶液4.00 mL,此滴定反应的离子方程式是____________。
(4)配制100 mL 0.100 0 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有________(填仪器名称)。滴定终点时溶液颜色为________色,且30秒内不变色。
(5)经计算,化合物KxFe(C2O4)y·3H2O中,x=________。
草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1: ; 假设2:FeO; 假设3:FeO和Fe的混合物。
②设计实验方案证明假设3。
限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
| 实验步骤 |
现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡 |
若溶液颜色明显改变,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
| 步骤3:取步骤2得到的少量固体于试管中,滴加 |
|
Ⅱ:某草酸亚铁样品中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5Fe2+ +5C2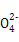 +3Mn
+3Mn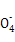 +24H+
+24H+ 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
①将准确称量的0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8 min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL。
③重复以上实验1~2次。
若某小组的一次测定数据记录如下:V1=" 18.90" mL,V2="6.20" mL。根据数据计算0.20 g样品中:n(Fe2+)= ; n(C2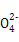 )= ;FeC2O4的质量分数为 (精确到0.01%)。
)= ;FeC2O4的质量分数为 (精确到0.01%)。
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下: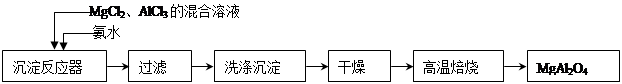

(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如图所示,过滤操作中的一处错误是 。
判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固 体的仪器名称是 。
(3)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成_________________沉淀(填化学式),生成该沉淀的离子方程式_____________________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]="3×10" -34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ;F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
(5)将Mg、Cu组成的3.92g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792L(标准状况),向反应后的溶液中加入4mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)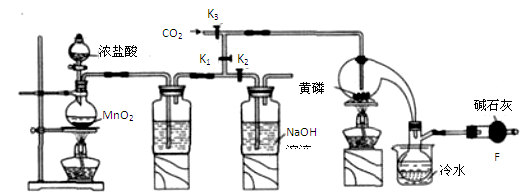
A B C D E
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生成 H3PO3和HC1。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,
E中冷水的作用是
F中碱石灰的作用是_____
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40mL
已知:H3PO3+H2O+I2="=" H3PO4+2HI,I2+2Na2S2O3==2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。