用氯气对饮用水消毒已有百年历史。这种消毒方法会使饮用水中的有机物发生氯代反应,生成有机含氯化合物,对人体有害,且氯气本身也是一种有毒气体。世界环保联盟即将全面禁止用氯气对饮用水消毒,建议推广采用广谱性高效消毒剂二氧化氯(ClO2)。目前欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,反应的化学方程式为:
___NaClO3+___HCl =___NaCl+___ClO2↑+___Cl2↑+___H2O。
(1)配平上述化学方程式。
(2)此反应中氧化剂是_______,在反应中盐酸体现的性质是_______和________。
(3)在标准状况下有4.48L氯气生成时,转移的电子数为_________mol,被氧化的盐酸的物质的量为________mol。
(4)我国研制成功用氯气氧化亚氯酸钠(在氮气保护下)制得ClO2,表示这一反应的化学方程式是2NaClO2 + Cl2 = 2ClO2↑+ 2A。已知A物质是一种盐,它的化学式为_________。这一方法的优点是 。
Ⅰ、某化学反应的反应物和产物为:KMnO4 + KI + H2SO4 → MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是 。
(2)如果该反应方程式中I2和KIO3的系数都是5,KMnO4的系数是 。
(3)在给出的化学式上标出电子转移的方向和数目: KMnO4 + KI + H2SO4 →
(4)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是______________。
Ⅱ、向盛有KI溶液的试管中加入少许CCl4后滴加氯水, CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式:

(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为橙红色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。据此判断下列反应能否进行HBrO3+HCl→ Br2+Cl2+H2O(未配平) 。(填“能”或“否”)
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2 L。(标准状况,保留2位小数)
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是________(写化学式)。
(2)写出并配平该反应的化学方程式:_________________________;
(3)发生还原反应的物质是________,反应中2mol的氧化剂能___________(填“失去”或“得到”)_________mol电子。
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为____________。
Ⅰ、现有A g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子的个数为________________个。
(2)该气体在标准状况下的密度为_______________ g/L。
(3)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________________mol/L。
Ⅱ、已知食盐常加人KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4 3K2SO4+3I2+3H2O
3K2SO4+3I2+3H2O
(1)如果反应中转移0.2mol电子,则生成I2的物质的量为 mol。
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)
若反应中消耗Cl2 1.5 mol,则被氧化的NH3在标准状况下的体积为______ L。
用KMnO4氧化密度为1.19g·cm-3,溶质质量分数为36. 5%的HCl溶液。反应方程式如下:
KMnO4+ HCl=== KCl+ MnCl2+ Cl2↑+ H2O
(1)请配平方程,并用双线桥法表示该反应电子转移情况
(2)盐酸的物质的量浓度
(3)15.8gKMnO4能氧化 mol的HCl,转移电子数约为
FeO易被氧化,配平:
_______FeO+_______HNO3(稀)=_______Fe(NO3)3+________NO↑+________H2O,
该反应中,氧化剂和还原剂的物质的量之比为____________;若反应中转移了0.15mol电子,则产生的气体在标准状况下的体积为__________L。
实验室常利用反应:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O来制取氯气。
MnCl2+Cl2↑+2H2O来制取氯气。
(1)用双线桥法标出反应中电子转移的方向和数目。
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)该反应中氧化剂是(填化学式,下同) ,氧化产物是________。
(3)该反应中氧化剂与还原剂物质的量之比为 。
(4)若有0.5 mol MnO2完全反应,则转移的电子的物质的量是 mol。
(1)用单线桥表示下列反应中电子转移方向和数目:
KIO3+6HI =KCl+3H2O+3I2
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素,测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C204+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是__________;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂__________ mol,有__________mol电子发生转移,相当于测出含钙元素的质量是_____g。
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸的冶炼钢铁的重要原料。高温下可发生反应:其中一个反应为:3FeS2+8O2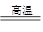 6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
(2)氯化铝溶液显酸性,原因是_________________________(用离子方程式稀释);
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2;它易被氧化),原理如下图所示。
①电源的负极为_________(填“A”或“B”)。
②阳极室中发生的反应依次为_________、_________。
③电解结束后,阴极室溶液的pH与电解前相比将_________;若阴极共收集到气体6.72L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
(4)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•moL-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•moL-1
H2O(g)═H2O(l)△H=-44.0kJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:_________。
Cu2S是一种灰黑色硫化物,不溶于水,能溶于硝酸。当溶于过量的一定浓度的硝酸时,生成Cu(NO3)2与CuSO4的混合溶液、NO气体和另一产物。
(1)写出该条件下反应的化学方程式: 。
(2)当有0.7 mol的SO42-生成时,该反应中转移的电子数为 。
(3)该反应中的氧化产物为 ,硝酸在该反应中体现了 (选填“氧化性”、“还原性”、“酸性”)。
(并非只有得氧、失氧的反应才是氧化还原反应,凡是有元素化合价升降的化学反应都是氧化还原反应。现在如下氧化还原反应,回答下列问题:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)氧化剂是_________,氧化产物是________
(2)未变价元素是_______,将反应成离子方程式________
(3)用单线桥表示转移的电子数:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(4)氧化产物和还原产物的质量之比为___________________
(5)反应中生成3.6gH2O,转移电子数为_______个。
(6)已知铵盐受热易分解,硝酸铵在一定条件下发生的分解反应为:5NH4NO3=2HNO3+4N2↑+9H2O,当生成还原产物0.6mol时,转移的电子的物质的量是_________mol。
居民饮用水的质量必须符合国家标准,以下是源水处理成自来水的工艺流程示意图。看图后回答下列问题。

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入过量石灰后生成Ca(OH)2,进而发生若干复分解反应,例如:HCO3-+OH-=CO32-+H2O 请写出另一个属于复分解反应的离子方程式 。
(2)凝聚剂除去悬浮固体颗粒的过程
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,其在水中电离出的Fe2+离子被溶解在水中的O2所氧化为Fe3+,最终生成胶状沉淀,这种胶状沉淀是 (写化学式)。
(3)配平下列反应方程式,并标出电子转移方向和数目。
Fe2++ O2 + H+="=" Fe3++ H2O
上述反应中,每转移8mol电子,标准状况下消耗O2的体积为___________L。
(4)通入二氧化碳的目的是 和 。
(5)Cl2的作用是 。
(6)Cl2是常用的强氧化剂,请你尝试写出一个合理的Cl2作为氧化剂的化学方程式。____________。
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166 /mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)①高铁酸钠主要通过如下反应制取: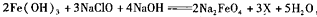 ,则X的化学式为
,则X的化学式为
②NNa2FeO4之所以能净水,除它本身具有强氧化性外,另一个原因可能是
(2)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请回答:
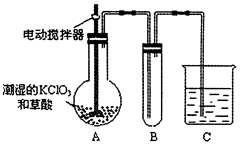
①A中反应产物有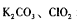 和CO2等,该反应氧化剂与还原剂物质的量之比为
和CO2等,该反应氧化剂与还原剂物质的量之比为
②A部分还应添加温度控制装置,如水浴加热或酒精灯、温度计,B部分还应补充的装置为___________,理由是
③该装置按②补充完整后,装置A、B、C中还有一处设计明显不合理的是 (填“A’’“B”或“C,’),请在图方框中画出该装置改正后的正确的装置图

④ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10mL,稀释成100mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:调节试徉的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知
当 时,可以判断此滴定操作到达终点;由以上数据可以计算原ClO2溶液的浓度为 g/I(用含字母的代数式表示)。
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么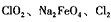 三种消毒杀菌剂的消毒效率最小的是 (填化学式)。
三种消毒杀菌剂的消毒效率最小的是 (填化学式)。
已知反应:2H2CrO4 + 3H2O2 2Cr(OH)3 + 3O2↑+ 2H2O该反应中H2O2只发生如下变化过程:H2O2→O2
(1)该反应中的还原剂是_______________________
(2)用单线桥法表示反应中电子转移的方向和数目
2H2CrO4 + 3H2O2 2Cr(OH)3 + 3O2↑+ 2H2O
(3)如反应中转移了0.6mol电子,则产生的气体在标准状况下体积为_______________________
(1)被称为“万能还原剂”的NaBH4溶于水发生反应:NaBH4+2H2O==NaBO2+4H2↑(已知:NaBH4中H为-1价),用双线桥分析电子转移情况:NaBH4+2H2O==NaBO2+4H2↑
反应中的还原剂是__________,被氧化的元素和被还原的元素的质量比是__________
(2)已知8NH3+3Cl2=6NH4Cl+N2反应中电子转移数为1.806×1023,则被氧化的物质的体积是_________(标准状况)
(3)在一定条件下, RO3n-和氟气发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是________