在一定条件下,NO跟NH3可发生反应:6NO+4NH3=5N2+6H2O。现有NO与NH3的混合物1mol,充分反应后所得产物中,经还原得到的N2比经氧化得到的N2多1.4g。
(1)标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算反应混合物中NO与NH3的物质的量可能各是多少。
将KCl和CrCl3两种固体混合物共熔发生化合反应制得化合物X。将5.405gX中Cr元素全部氧化成Cr2O72-,酸性的Cr2O72-可与过量的KI发生氧化还原反应氧化出7.62g I2,同时Cr2O72-被还原成Cr3+,如果取溶有X 5.405g的溶液,加入过量的AgNO3,可得12.915gAgCl沉淀。(1)写出Cr2O72-与I-反应的离子方程式
(2)通过计算得出X的化学式
为了测定某铜银合金的成分。将30.0g合金完全溶于80ml 13.5mol/L的浓HNO3中,待合金完全溶解后,收集到NO和NO2的混合气体共6.72L(标准状况),并测得溶液中氢离子浓度为1mol/L。假设反应后溶液的体积仍为80ml。试计算:
(1)被还原的硝酸的物质的量。
(2)合金中银的质量分数。
实验室用二氧化锰和浓盐酸反应制取氯气。
(1)若用200mL10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为 0.5mol(填“大于”、“等于”或“小于”),原因是 。
(2)870g二氧化锰与足量的浓盐酸反应,则被氧化的氯化氢的物质的量是多少?
(6分)用足量的NaOH溶液将448mlCl2(标准状况)完全吸收,计算①生成的NaClO的物质的量;②该反应中氧化剂与还原剂的物质的量之比;③该反应中电子转移总数。
实验室里用二氧化锰与浓盐酸反应 来制取适量的氯气。现用浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为11.2升,(假设HCl全部参加反应)
来制取适量的氯气。现用浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为11.2升,(假设HCl全部参加反应)
(M
 nO2+4HCl(浓)
nO2+4HCl(浓) MnCl2+2H2O+Cl2↑)
MnCl2+2H2O+Cl2↑)
计算:(1)参加的二氧化锰的质量。 (2)被氧化的HCl的物质的量。
用15.8g KMnO4氧化75mL足量浓盐酸。反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)有多少克HCl被氧化?
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度?
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I- (忽略水的电离),其中Cl-、Br-、I-的个数比为
(忽略水的电离),其中Cl-、Br-、I-的个数比为 2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,求通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比。(已知:还原
2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,求通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比。(已知:还原 性I->Fe2+>Br->Cl-)
性I->Fe2+>Br->Cl-)
CuO和木炭组成的混合物4.24g,在高温的条件下充分反应后,剩余固体混合物呈红色,质量为3.36g,若反应产生的气体能全部被过量的澄清石灰水吸收,得沉淀2.00g,通过计算指出所得固体产物的组成及质量分数。
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。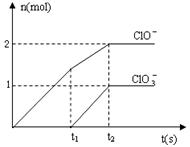
(1)t2时,Ca(OH)2与Cl2发生反应的总化学方程式为:____________ 。
(2)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若 ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
验室常用浓盐酸与二氧化锰反应来制取氯气,反应的化学方程式4HCl+MnO2="=" MnCl2+2H2O+Cl2↑现用密度为1.1 9g/cm3、质量分数为36.5%的浓盐酸与二氧化锰反应,生成的氯气在标准状况下的体积为5.6L。计算:
(1)浓盐酸中HCl的物质的量浓度。
(2)需要消耗二氧化锰多少克?
(3)被氧化的HCl的物质的量是多少?
实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为(未配平)KClO3+HCl——HCl+Cl2↑+H2O
(1)配平上述反应化学方程式:
KClO3+ HCl—— KCl+ Cl2↑+ H2O
(2)若产生0.1mol Cl2,则转移电子的物质的量为 mol。
(3)若反应中HCl的的利用率只有50%,当氧化产物比还原子能产物多7.1g时,求浓盐
酸的物质的量浓度。
在反应Fe3O4 +4CO 3Fe+4CO2中,
3Fe+4CO2中,
是氧化剂, 元素被氧化,氧化产物和还原产物的物质的量之比为 ,若生成的CO2在标准状况下为8.96L,则该反应中转移电子为 mol。