高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的化学方程式是:4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
干法制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法中错误的是
| A.高铁酸钾处理水时,水发生氧化反应 |
| B.湿法中每生成1mol Na2FeO4共转移3mol电子 |
| C.干法中每生成1mol Na2FeO4共转移4mol电子 |
| D.K2FeO4处理水时,不仅能杀菌,并能使悬浮杂质沉降 |
己知在碱性溶液中可发生如下反应:2R(OH)3 + 3C1O-+ 4OH- = 2RO4n-+3Cl-+5H2O。则RO4n-中 R 的化合价是
| A.+3 | B.+4 | C.+5 | D.+6 |
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
下列有关说法错误的是
| A.氧化性:Cr2O72->Fe3+>SO2 |
| B.K2Cr2O7能将Na2SO3氧化成Na2SO4 |
| C.每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA |
| D.若有6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7 |
24mL浓度为0.05mol・L﹣1的Na2SO3溶液,恰好与20mL浓度为0.02mol・L﹣1的K2Cr2O7溶液完全反应,已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
| A.+2 | B.+3 | C.+4 | D.+5 |
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,向溶液中通入氯气,使溶液中Cl-和Br-的个数比为7:3(已知还原性I->Fe2+>Br->Cl-),则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为
| A.5:4 | B.4:5 | C.5:12 | D.12:5 |
硫代硫酸钠(Na2S2O3)可作为还原剂,已知25.0mL0.0100mol/LNa2S2O3溶液恰好把22.4mL(标准状况下)Cl2完全转化为Cl 离子, 则S2O32- 将转化成( )
离子, 则S2O32- 将转化成( )
| A.S2- | B.S | C.SO32- | D.SO42- |
在1000 mL含有等物质的量的HBr和H2SO3溶液中通入0.01 molCl2,有一半 变为Br2,原溶液中HBr和H2SO3的浓度都等于
变为Br2,原溶液中HBr和H2SO3的浓度都等于
A.0.007 5 mol· |
B.0.008 mol· |
C.0.075 mol· |
D.0.08 mol· |
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。横、纵坐标的单位均为mol。
有关说法不正确的是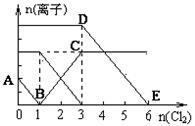
| A.线段BC代表Fe2+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)=3 mol/L |
| C.原溶液中n (Fe2+): n (I-): n(Br-)=2:1:3 |
| D.当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
已知S2O8n-离子和H2O2一样含有过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子,若反应后S2O8n-离子生成SO42-离子;又知反应中氧化剂与还原剂的离子数之比为5:2,则S2O8n-中的n值和S元素的化合价是
| A.2, +6 | B.2, +7 | C.4 ,+6 | D.4 , +7 |
某容器中发生一个化学反应,反应过程中存在H2O、ClO﹣、CN﹣、HCO3﹣、N2、Cl﹣六种离子。在反应过程中测得ClO﹣和N2的物质的量随时间变化的曲线如图所示.下列有关判断中不正确的是
| A.还原剂是含CN﹣的物质,氧化产物不只有N2 |
| B.氧化剂是ClO﹣,还原产物是HCO3﹣ |
| C.参与反应的氧化剂与还原剂的物质的量之比为5:2 |
| D.标准状况下若生成2.24LN2则转移电子1mol |
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)
| A.0.448L | B.2.240L | C.2.016L | D.无法确定 |
将0.15molFe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
| A.0.05mol/L | B.0.1mol/L | C.0.2mol/L | D.0.3mol/L |
0.3molSO32-恰好将0.2molXO4-离子还原,则X元素在还原产物中的化合价是( )
| A.+1 | B.+2 | C.+3 | D.+4 |
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )

| A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 |
| B.图中C点对应溶液体积为48mL |
| C.原硝酸溶液中含硝酸的物质的量为0.5mol |
| D.样品中铝粉和铁粉的物质的量之比5:3 |