将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体(NOx)的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为
| A.0.05 mol | B.0.13 mol | C.1.05 mol | D.1 mol |
有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是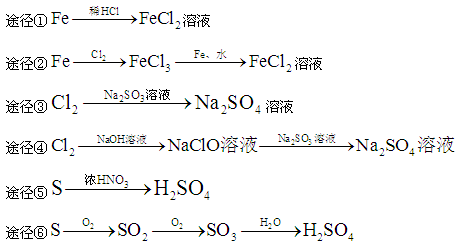
| A.由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- |
| B.由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- |
| C.由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- |
| D.以上说法都不正确 |
将一定量的锌与200 mL 18.5 mol·L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况)。将反应后的溶液稀释到2 L,测得溶液中c(H+)=1mol·L-1,则下列叙述中错误的是
| A.反应中共转移电子3mol |
| B.反应中共消耗锌97.5 g |
| C.气体A中SO2和H2的体积比为4∶1 |
| D.稀释后的溶液中c(SO42―)="1.55" mol·L-1 |
实验室将NaClO3和Na2SO3按物质的量之比2∶1 倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X 为
| A.Cl2 | B.ClO2 | C.Cl2O | D.Cl2O3 |
聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.1650 g。另一份溶液,先将Fe3+还原为Fe2+,再用0.0200 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液33.33 mL。该聚合硫酸铁样品中a∶b的比值为(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O)。
| A.2∶1 | B.3∶1 | C.1∶1 | D.4∶5 |
工业废气中氮氧化物是主要污染物,为了治理污染,常通入NH3,发生反应NOx+NH3―→N2+H2O来治理污染.现有NO、NO2的混合气体3 L,用同温同压下3.5 LNH3使其恰好完全转化为N2,则混合气体中NO、NO2的物质的量之比为
| A.1∶1 | B.1∶3 | C.2∶1 | D.1∶4 |
往100 mL氢离子浓度为1mol·L-1的硫酸和硝酸混合液中投入3.84 g铜粉,微热使反应充分完成后,生成NO气体448 mL(标准状况)。则反应前的混合液中含硫酸的物质的量为
| A.0.01mol | B.0.02 mol | C.0.03 mol | D.0.04 mol |
NA2Sx在碱性溶液中可被NAClO氧化为NA2SO4,而NAClO被还原为NACl,若反应中NA2Sx与NAClO的物质的量之比为1∶16,则x的值为
| A.2 | B.3 | C.4 | D.5 |
在FeCl3和CuCl2的混合溶液中加入过量铁粉,反应完全后剩余固体的质量大于加入的铁粉质量。已知原混合溶液中FeCl3为0.4 mol,则CuCl2的物质的量可能是
| A.0.2 mol | B.0.6 mol | C.1.2 mol | D.2 mol |
现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸的浓度为4mol/L,稀硝酸的浓度为2 mol/L。取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到的气体成分为 、 ;体积分别是 L、 L。(假设HNO3只被还原为NO)
向由Cu、Cu2O和CuO组成的混合物中,加入10 mL 6 mol·L-1的稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 224 mL。请回答以下问题:
(1)写出Cu2O与稀硝酸反应的离子方程式 。
(2)产物中硝酸铜的物质的量为 。
(3)若原混合物中有0.01molCu,则其中Cu2O的物质的量为 ,CuO的物质的量为 。
向含a mol H2SO4的质量分数为98%的浓硫酸中加入足量的铜片并加热,充分反应后有b mol H2SO4被还原,则a和b的关系是
| A.a=b | B.a=2b | C.a / 2 < b < a | D.a >2b |
32g铜与150mL一定浓度的硝酸恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L。则该硝酸的物质的量浓度为
| A.5mol/L | B.15mol/L | C.10mol/L | D.8mol/L |
将25.6g铜与足量的浓硫酸共热,完全反应后,试计算:
(1)生成的SO2在标准状况下的体积;
(2)被还原的硫酸的物质的量。